题目内容
18.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2═LiMnO2.下列说法正确的是( )| A. | Li是负极,电极反应为Li-e-═Li+ | |
| B. | Li是正极,电极反应为Li+e-═Li- | |
| C. | MnO2是负极,电极反应为MnO2+e-═MnO2- | |
| D. | 锂电池是一种可充电电池 |
分析 在原电池中,失电子的金属为负极,发生失电子的氧化反应,得电子的物质在正极发生还原反应,锂电池是一种体积小,储存能量较高的可反复充电的环保电池.
解答 解:A、根据锂电池的总反应式Li+MnO2=LiMnO2,失电子的金属Li为负极,电极反应为:Li-e-=Li+,故A正确;
B、根据锂电池的总反应式Li+MnO2=LiMnO2,失电子的金属Li为负极,电极反应为:Li-e-=Li+,故B错误;
C、MnO2是正极,电极反应为MnO2+e-=MnO2-,故C错误;
D、锂电池是一种体积小,储存能量较高的可反复充电的环保电池,故D正确.
故选AD.
点评 本题考查学生原电池的工作原理以及原电池中正负极的判断方法知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
9.下列各组物质中,所含分子数一定相同的是( )
| A. | 1gH2和8gO2 | |
| B. | 0.1molHCl和2.24LHe | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
6.某反应由两步反应A?B?C构成,它的反应能量曲线如图,下列叙述正确的是( )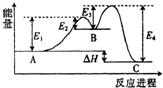

| A. | 两步反应均为吸热反应 | B. | 三种化合物中C最稳定 | ||
| C. | 加入催化剂会改变反应的反应热 | D. | A?B反应,反应条件一定要加热 |
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | Na20和Na2O2的混合物共1mol,阴离子数目为NA | |
| B. | 1mol Na被完全氧化生成Na2O2,失去2NA个电子 | |
| C. | 7.8g Na2O2与足量CO2反应,转移的电子数为0.2NA | |
| D. | 1L 0.1mol•L-1的Na2S溶液中含有0.1NA S2-离子 |
8.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 酸性溶液中可能大量存在:Na+、Fe2+、ClO-、SO42- | |
| C. | 弱碱性溶液中可能大量存在:Na+、K+、Cl-、HCO3- | |
| D. | 中性溶液中可能大量存在:Fe3+、K+、Cl-、SO42- |
 A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:
A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下: