题目内容
18.设NA为阿伏伽德罗常数,下列叙述正确的是( )| A. | 23g钠的原子最外层电子数为2NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4L乙烷的分子数为NA | |
| D. | 1mol甲基所含质子数为10NA |
分析 A.钠原子最外层含有1个电子,23g钠的物质的量为1mol,1mol钠原子的最外层含有1mol电子;
B.水为弱电解质,只能部分电离出氢离子;
C.标准状况下22.4L乙烷的物质的量为1mol;
D.甲基中含有9个质子,1mol甲基中含有9mol质子.
解答 解:A.23g钠原子的物质的量为:$\frac{23g}{23g/mol}$=1mol,1mol钠原子含有1mol最外层电子,含有的最外层电子数为NA,故A错误;
B.1L0.1mol•L-1乙酸溶液中含有0.1mol乙酸,0.1mol乙酸只能部分电离出H+,则溶液中含有的氢离子数目小于0.1NA,故B错误;
C.标准状况下,22.4L乙烷的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,含有的分子数为NA,故C正确;
D.1mol甲基中含有9mol质子,所含质子数为9NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量等之间关系为解答关键,注意甲基与甲烷、羟基与氢氧根离子的区别.

练习册系列答案
相关题目
11.关于FeCl3溶液水解的错误说法是( )
| A. | FeCl3水解使溶液呈酸性,并能起净水作用,使水中悬浮的杂质沉降 | |
| B. | 浓度为5mol•L-1和0.5mol•L-1的两种FeCl3溶液,其它条件相同时,Fe3+离子的水解程度前者比后者低 | |
| C. | 加热FeCl3溶液并蒸干,再灼烧,此时得到的固体是无水氯化铁 | |
| D. | 为了抑制Fe3+的水解,更好地保存FeCl3溶液,应向其中加入少量的盐酸 |
13.在一定温度下的恒容密闭容器中,取一定量的A、B于反应容器中,当下列物理量(或比值)不再改变时,不能表明反应A(s)+2B(g)?C(g)+D(g) 已达平衡状态的是( )
| A. | 混合气体的密度 | B. | 气体B、C的物质的量浓度之比 | ||
| C. | 气体B、D的质量之比 | D. | 气体C、D的物质的量之比 |
10.某溶液能与铝反应产生氢气,在该溶液可能大量存在的一组离子是( )
| A. | Na+、Fe2+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、Mg2+、SO42-、Na+ | D. | Na+、NH4+、CO32-、SO42- |
7.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
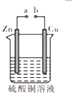

| A. | a和b不连接时,锌片上会有紫红色固体析出 | |
| B. | a和b用导线连接时,铜片上的电极反应是Cu2++2e-→Cu | |
| C. | a和b用导线连接时,溶液的颜色加深 | |
| D. | 无论a和b是否连接,锌片均会溶解 |
 A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下:
A、B、C、D、E是中学化学常见的物质.其中,A、B是短周期元素组成的非金属单质,C是金属单质,D是无色液体.其转化关系如下: