题目内容
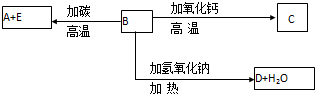
Ⅰ.A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图1(部分反应中的水已略去).
若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是 ,属于 分子(填“极性”或“非极性”)
②氯碱工业制备A的化学方程式是 .
③A、C反应的离子方程式是 .
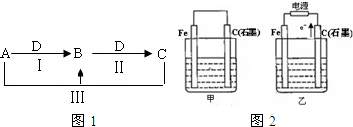
Ⅱ.如图2甲、乙是电化学实验装置.
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为 .
②将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为 .
(2)若起始时乙中盛有200mL pH=5的足量的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填物质的化学式) g.

若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是
②氯碱工业制备A的化学方程式是
③A、C反应的离子方程式是
Ⅱ.如图2甲、乙是电化学实验装置.
(1)若甲、乙两烧杯中均盛有NaCl溶液.
①甲中石墨棒上的电极反应式为
②将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为
(2)若起始时乙中盛有200mL pH=5的足量的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入
考点:无机物的推断,原电池和电解池的工作原理
专题:推断题,电化学专题
分析:I.若A为氯碱工业的产品,C为厨房中的用品,可知A为NaOH,C为NaHCO3,B为Na2CO3,D为CO2,结合物质结构与性质解答;
Ⅱ.如图2甲、乙是电化学实验装置.甲为原电池,Fe为负极,C为正极,电解质为NaCl,发生吸氧腐蚀;乙为电解池,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,以此来解答.
Ⅱ.如图2甲、乙是电化学实验装置.甲为原电池,Fe为负极,C为正极,电解质为NaCl,发生吸氧腐蚀;乙为电解池,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,以此来解答.
解答:
解:I.若A为氯碱工业的产品,C为厨房中的用品,可知A为NaOH,C为NaHCO3,B为Na2CO3,D为CO2,
①D的电子式是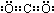 ,为直线型结构,结构对称,为非极性分子,故答案为:
,为直线型结构,结构对称,为非极性分子,故答案为: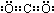 ;非极性;
;非极性;
②A为NaOH,氯碱工业制备A的化学方程式是2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
③A、C反应的离子方程式是HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
II.甲为原电池,Fe为负极,C为正极,电解质为NaCl,发生吸氧腐蚀;乙为电解池,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,
(1)①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,
故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
(2)由2CuSO4+2H2O
2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,
m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g,
故答案为:CuO(或CuCO3);0.8(或1.24).
①D的电子式是
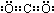 ,为直线型结构,结构对称,为非极性分子,故答案为:
,为直线型结构,结构对称,为非极性分子,故答案为: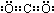 ;非极性;
;非极性; ②A为NaOH,氯碱工业制备A的化学方程式是2NaCl+2H2O
| ||
| ||
③A、C反应的离子方程式是HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
II.甲为原电池,Fe为负极,C为正极,电解质为NaCl,发生吸氧腐蚀;乙为电解池,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,
(1)①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,
故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
(2)由2CuSO4+2H2O
| ||
m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g,
故答案为:CuO(或CuCO3);0.8(或1.24).
点评:本题考查无机物的推断和电化学反应原理,为高考常见题型和高频考点,侧重于氯碱工业及电化学反应原理的考查,注重分析能力、推断能力及计算能力的综合训练,题目难度中等.

练习册系列答案
相关题目
下列微粒中,只具有还原性的是( )
| A、Na+ |
| B、N2 |
| C、Cl- |
| D、SO32- |
既可以鉴别甲烷和乙烯,又可以用来除去甲烷中的乙烯的方法是( )
| A、混合气体通过盛水的洗气瓶 |
| B、混合气体通过装有过量溴水的洗气瓶 |
| C、混合气体和过量氢气混合 |
| D、混合气体通过酸性高锰酸钾溶液 |
所有原子都在一条直线上的分子是( )
| A、C2H4 |
| B、CO2 |
| C、C3H4 |
| D、CH4 |
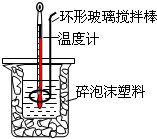 测定中和热实验装置如图:
测定中和热实验装置如图: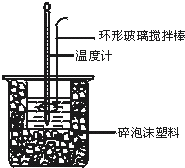 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: