题目内容
如图1所示,恒温条件下,某容器分隔成A、B两部分,A容积固定不变,B有可移动活塞,在相同温度下发生可逆反应2SO2(g)+O2(g)?2SO3(g).根据要求填写空白:
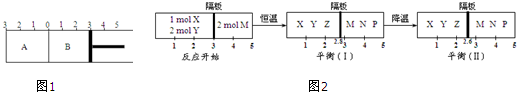
(1)如果A中充入2mol SO2和1mol O2,在B中充入2mol SO2和1mol O2,则SO2转化率谁大 (填A或B,下同),先达到平衡的是 ,达平衡后,测得A中气体的总物质的量2.1mol,则n(SO3)= mol
(2)如果A中充入2mol SO2和1mol O2,在B中充入2mol SO3和1mol N2
①固定活塞位置在3处不动,达到平衡时,A中压强 B中压强(填大于;等于;小于)
②若要使A与B中的反应物与生成物对应物质的量之比相同,活塞的位置应在 处;
③若活塞右移到5处,达平衡后,A中SO3的物质的量 B中SO3的物质的量(填大于;等于;小于)
④B中活塞固定在4.5处,要使A和B中平衡状态与②相同,需再向B中加入SO2 mol,加入O2
mol
(3)若在如图2所示的容器中分别进行如下两个可逆反应:
①X(g)+2Y(g)?2Z(g)和 ②2M(g)?N(g)+P(g),
反应室之间用无摩擦、可滑动的密封隔板隔开.反应开始和达到平衡状态时有关物理量的变化如图2所示:
则:反应①的正反应是 反应(填吸热或放热),达到平衡(I)时体系的压强与反应开始时体系的压强之比为 ,达平衡(I)时,X的转化率为 .

(1)如果A中充入2mol SO2和1mol O2,在B中充入2mol SO2和1mol O2,则SO2转化率谁大
(2)如果A中充入2mol SO2和1mol O2,在B中充入2mol SO3和1mol N2
①固定活塞位置在3处不动,达到平衡时,A中压强
②若要使A与B中的反应物与生成物对应物质的量之比相同,活塞的位置应在
③若活塞右移到5处,达平衡后,A中SO3的物质的量
④B中活塞固定在4.5处,要使A和B中平衡状态与②相同,需再向B中加入SO2
mol
(3)若在如图2所示的容器中分别进行如下两个可逆反应:
①X(g)+2Y(g)?2Z(g)和 ②2M(g)?N(g)+P(g),
反应室之间用无摩擦、可滑动的密封隔板隔开.反应开始和达到平衡状态时有关物理量的变化如图2所示:
则:反应①的正反应是
考点:化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)B容器中随反应的进行物质的量要减小,容器体积要缩小,相当于增大压强;
(2)根据左右两个容器压强相等,从等效平衡的角度分析;
(3)根据右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,结合图示容器容积变化判断降温后反应①平衡移动的方向;根据右室的混合物总物质的量不变,在同温同压下体积比等于物质的量之比计算出反应后(I)中混合气体的物质的量,再计算出达平衡(I)时体系的压强与反应开始时体系的压强之比;设参加反应的X的物质的量为amol,利用差量法计算a的值,再利用转化率定义计算A的转化率.
(2)根据左右两个容器压强相等,从等效平衡的角度分析;
(3)根据右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,结合图示容器容积变化判断降温后反应①平衡移动的方向;根据右室的混合物总物质的量不变,在同温同压下体积比等于物质的量之比计算出反应后(I)中混合气体的物质的量,再计算出达平衡(I)时体系的压强与反应开始时体系的压强之比;设参加反应的X的物质的量为amol,利用差量法计算a的值,再利用转化率定义计算A的转化率.
解答:
解:(1)B容器中随反应的进行物质的量要减小,容器体积要缩小,相当于增大压强,所以B中SO2转化率大,B的速率快,达平衡所需的时间短,由反应可知2SO2(g)+O2(g)?2SO3(g)的减少量就是氧气的量,2mol+1mol-2.1mol=0.9mol,所以生成n(SO3)=0.9mol×2=1.8mol,故答案为:B;B;1.8;
(2)A中充入2 mol SO2和1 mol O2与B中充入2 mol SO3和1 mol N2,由于N2与反应无关,故只占分压.活塞在3处时相同条件下达平衡时是等效的,但B中有1 mol N2,故压强比A大.
若使A与B中平衡状态相同且达平衡时活塞在4.5处,则B中必须相当于3 mol SO2和1.5 mol O2,故应再通入SO3 1 mol.若活塞右移到5处,则B中压强减小平衡向生成SO2的方向移动,故n(SO3)减小,3个体积充入2mol SO2和1mol O2,4.5个体积应充3mol SO2和1.5mol O2,所以再充入二氧化硫和氧气的物质的量分别为:1;0.5,故答案为:①小于; ②3;③大于; ④1;0.5;
(3)右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.8处移至2.6处,左室的气体的物质的量减小,降低温度平衡向正反应移动,降低温度平衡向放热反应移动,故该反应正反应为放热反应;平衡时,右边物质的量不变,由图可以看出达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为:
=
;达平衡(Ⅰ)时,右边气体的物质的量不变,仍为2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,
则有:
=
,x=
=
mol,即物质的量减少了3-
=
mol,所以达平衡(Ⅰ)时,X的转化率为
;故答案为:放热;
;
.
(2)A中充入2 mol SO2和1 mol O2与B中充入2 mol SO3和1 mol N2,由于N2与反应无关,故只占分压.活塞在3处时相同条件下达平衡时是等效的,但B中有1 mol N2,故压强比A大.
若使A与B中平衡状态相同且达平衡时活塞在4.5处,则B中必须相当于3 mol SO2和1.5 mol O2,故应再通入SO3 1 mol.若活塞右移到5处,则B中压强减小平衡向生成SO2的方向移动,故n(SO3)减小,3个体积充入2mol SO2和1mol O2,4.5个体积应充3mol SO2和1.5mol O2,所以再充入二氧化硫和氧气的物质的量分别为:1;0.5,故答案为:①小于; ②3;③大于; ④1;0.5;
(3)右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.8处移至2.6处,左室的气体的物质的量减小,降低温度平衡向正反应移动,降低温度平衡向放热反应移动,故该反应正反应为放热反应;平衡时,右边物质的量不变,由图可以看出达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为:
| 2 |
| 2.2 |
| 10 |
| 11 |
则有:
| 2 |
| x |
| 2.2 |
| 2.8 |
| 2×2.8 |
| 2.2 |
| 28 |
| 11 |
| 28 |
| 11 |
| 5 |
| 11 |
| 5 |
| 11 |
| 10 |
| 11 |
| 5 |
| 11 |
点评:本题考查化学平衡移动的计算和判断,本题难度较大,做题注意从右边反应体系中的物质的量不变考虑,注意等效平衡的理解和应用.

练习册系列答案
相关题目
在下列分子中,能够在同一个平面内的原子数最多的是( )
| A、甲烷 |
| B、一溴甲烷(CH3Br) |
| C、乙烯 |
| D、CH2=CH-C≡CH |
下列表述不正确的是( )
| A、福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 |
| B、电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
| C、凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体 |
| D、钠原子L层共有8种运动状态不同的电子 |
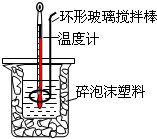 测定中和热实验装置如图:
测定中和热实验装置如图: 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: