题目内容
【题目】I.工厂采用含硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3 mol/L,氢氟酸的浓度为8 mol/L。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol/L,硫酸的浓度为1 mol/L。现要用此回收酸液配制上述萃取液,在400 L回收酸液中加入________________L(小数点后保留一位有效数字)密度为1.84 g/cm3、浓度为98%的浓硫酸,然后 ________,即可得到符合要求的萃取液。
II.某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
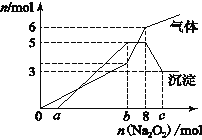
(1)该溶液中一定含有的阳离子是____________________,其对应物质的量浓度之比为___________________________,溶液中一定不存在的阴离子是_________________________。
(2)写出沉淀减少的离子方程式_____________________。
【答案】76.1 加水稀释至600L H+、Al3+、NH4+ 、Mg2+ 2:2:2:3 OH-、CO32-、AlO2- Al(OH)3+OH-=== AlO2- +2H2O
【解析】
I.设稀释后溶液体积为V,根据稀释定律,稀释前后HF的物质的量不变,据此计算稀释后溶液的体积;
符合萃取液要求,应保证硫酸、氢氟酸的浓度分别为3mol·L-1、8mol·L-1,根据氢氟酸的浓度可知加入浓硫酸,再加水稀释后溶液的体积,设需加浓硫酸的体积为x,根据H2SO4物质的量守恒,列方程计算.
II.(1)根据生成的沉淀总物质的量最大量为5mol、最终得到3mol可知,最终得到的沉淀为3mol氢氧化镁沉淀,溶解的2mol沉淀为氢氧化铝;根据气体的物质的量最后有增加可知,增加的气体为氨气,溶液中一定存在铵离子;根据开始加入过氧化钠时没有沉淀生成,说明原溶液中存在氢离子,根据题中数据计算出氢离子的物质的量;
(2)沉淀中氢氧化铝沉淀能够与氢氧化钠溶液反应而导致沉淀减少,据此写出反应的离子方程式.
I.设稀释后溶液体积为V,根据稀释定律,稀释前后HF的物质的量不变,则有:8mol·L-1×V=12mol·L-1×400L,解得V=600L;
符合萃取液要求,应保证硫酸、氢氟酸的浓度分别为3mol·L-1、8mol·L-1,根据氢氟酸的浓度可知可知加入浓硫酸,再加水稀释后溶液的体积为600L,
设需加浓硫酸的体积为x,根据H2SO4物质的量守恒,则有:
x×1.84g·cm-3×98%/98g·mol-1+400L×1mol·L-1=600L×3mol·L-1,解得x=7.61×104 mL=76.1L。
II.(1)根据图象中沉淀先增加后部分溶解可知:溶液中一定含有:Mg2+和Al3+,所以一定不含CO32-、AlO2-,并且含有镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol,根据元素守恒,所以含有铝离子的物质的量2mol;
加入8mol过氧化钠会生成4mol氧气,而图象中生成了6mol气体,说明生成的气体除了过氧化钠和溶液反应生成的氧气之外,还一定有2mol其他气体生成,而只能是氨气,所以一定含有2mol铵根离子,所以一定不含有氢氧根离子;图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+,由于加入8mol过氧化钠时生成的沉淀达到最大量5mol,8mol过氧化钠会生成16mol氢氧化钠,而生成2mol氢氧化铝、3mol氢氧化镁、2mol氨气消耗的氢氧化钠为:2mol×3+3mol×2+2mol=14mol,所以有2mol氢氧化钠与氢离子反应,氢离子的物质的量为2mol;
并且物质的量为2mol,溶液中一定还含有阴离子,可能为氯离子,钾离子不能确定是否存在,
根据电荷守恒:所以n(H+)+3n(Al3+)+n(NH4+)+2n(Mg2+)≤2n(SO42-),所以氯离子物质的量≥16mol,即:
离子种类 H+ Al3+ NH4+ Mg2+ Cl-
物质的量(mol)2 2 2 3 ≥16
所以溶液中一定存在的阳离子为:H+、Al3+、NH4+、Mg2+;含有的阳离子的物质的量之比为:n(H+):n(Al3+):n(NH4+):n(Mg2+)=2:2:2:3;溶液中一定不存在的阴离子为:OH-、CO32-、AlO2-,
故答案为:H+、Al3+、NH4+、Mg2+;2:2:2:3;OH-、CO32-、AlO2-;
(2)生成的沉淀为氢氧化镁和氢氧化铝,其中氢氧化铝能够与氢氧化钠溶液反应,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O。

 通城学典默写能手系列答案
通城学典默写能手系列答案