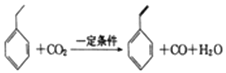
题目内容
【题目】200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为( )
A. 5.8g·mol-1 B. 11.6 g·mol-1
C. 23.2g·mol-1 D. 46.4g·mol-1
【答案】C
【解析】试题分析:向足量的过氧化钠固体中通入二氧化碳和水,固体只增加3.6克,是因为生成了氧气,所以氧气的质量为11.6-3.6=8克,即0.25摩尔,根据方程式的特点,说明二氧化碳和水的物质的量总和为0.5摩尔,所以原混合气体的平均摩尔质量为11.6/0.5=23.2g·mol—1,选C。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】I.工厂采用含硫酸和氢氟酸的溶液作为矿物中稀有元素的萃取液,生产要求该萃取液中硫酸的浓度为3 mol/L,氢氟酸的浓度为8 mol/L。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol/L,硫酸的浓度为1 mol/L。现要用此回收酸液配制上述萃取液,在400 L回收酸液中加入________________L(小数点后保留一位有效数字)密度为1.84 g/cm3、浓度为98%的浓硫酸,然后 ________,即可得到符合要求的萃取液。
II.某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
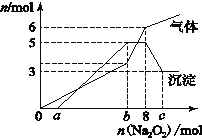
(1)该溶液中一定含有的阳离子是____________________,其对应物质的量浓度之比为___________________________,溶液中一定不存在的阴离子是_________________________。
(2)写出沉淀减少的离子方程式_____________________。