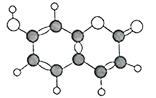
ћвƒњƒЏ»Ё
°Њћвƒњ°њЋж‘≠„”–т эµЁ‘ц£ђ∞Ћ÷÷ґћ÷№∆Џ‘™ЋЎ(”√„÷ƒЄx±н Њ)‘≠„”∞лЊґµƒѕаґ‘іу–°°Ґ„оЄя’эЉџїт„оµЌЄЇЉџµƒ±дїѓ»зѕ¬ЌЉЋщ Њ°£

ЄщЊЁ≈–ґѕїЎірѕ¬Ѕ–ќ ћв:
£®1£©f‘Џ÷№∆Џ±н÷–µƒќї÷√ «__________°£
£®2£©±»љѕd°Ґe≥£Љыјл„”µƒ∞лЊґіу–°(”√їѓ—І љ±н Њ,ѕ¬Ќђ):_______>__________£ї________±»љѕg°Ґhµƒ„оЄяЉџ—хїѓќпґ‘”¶ЋЃїѓќпµƒЋб–‘«њ»х:_______>__________°£____________
£®3£©»ќ—°…ѕ ц‘™ЋЎ„й≥…“ї÷÷Ћƒ‘≠„”є≤ЉџїѓЇѕќп£ђ–і≥ц∆дµз„” љ:_________________°£
£®4£©–і≥цeµƒµ•÷ ‘Џ„гЅњd2÷–»Љ…’Јі”¶µƒїѓ—ІЈљ≥ћ љ:____________________________°£
£®5£©…ѕ ц‘™ЋЎњ…„й≥…—ќR:zx4f(gd4)2°£ѕт Ґ”–10 mL 1 mol°§L£≠1R»№“Їµƒ…’±≠÷–÷рµќЉ”»л1 mol°§L£≠1NaOH»№“Ї£ђ≥Ѕµнµƒќп÷ µƒЅњЋжЉ”»лNaOH»№“Їћеїэµƒ±дїѓ Њ“вЌЉ»зѕ¬:
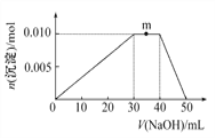
Ґў–і≥цmµгЈі”¶µƒјл„”Јљ≥ћ љ:____________________________°£
ҐЏ»ф‘ЏR»№“Ї÷–ЄƒЉ”20 mL1.2 mol°§L£≠1Ba(OH)2»№“Ї,≥дЈ÷Јі”¶Їу,»№“Ї÷–≤ъ…ъ≥Ѕµнµƒќп÷ µƒЅњќ™_______mol°£
°Њір∞Є°њµЏ3÷№∆ЏҐуA„е r(O2£≠) r(Na£Ђ) HClO4 H2SO4 ![]() (їт
(їт![]() їт
їт![]() µ»∆дЋыЇѕјнір∞ЄЊщњ…) 2Na £ЂO2
µ»∆дЋыЇѕјнір∞ЄЊщњ…) 2Na £ЂO2 ![]() Na2O2 NH4+£ЂOH£≠NH3°§H2O 0.022
Na2O2 NH4+£ЂOH£≠NH3°§H2O 0.022
°Њљвќц°њ
±Њћв±Њћв÷ч“™њЉ≤й‘™ЋЎµƒ–‘÷ °£
(1)і”‘≠„”∞лЊґµƒѕаґ‘іу–°ЇЌїѓЇѕЉџ≈–ґѕf «¬Ѕ£ђf‘Џ÷№∆Џ±н÷–µƒќї÷√ «µЏ3÷№∆ЏҐуA„е°£
(2) і”‘≠„”∞лЊґµƒѕаґ‘іу–°ЇЌїѓЇѕЉџ≈–ґѕd «—х£ђe «ƒ∆£ђO2£≠”лNa£Ђµƒµз„”≤гљбєєѕаЌђ£ђјл„”∞лЊґЋж„≈ЇЋµзЇ… э‘цґаґшЉх–°£ђјл„”µƒ∞лЊґr(O2£≠) > r(Na£Ђ) £їі”‘≠„”∞лЊґµƒѕаґ‘іу–°ЇЌїѓЇѕЉџ≈–ґѕg «Ѕт£ђh «¬»£ђg°Ґhµƒ„оЄяЉџ—хїѓќпґ‘”¶ЋЃїѓќпµƒЋб–‘«њ»х£ЇHClO4> H2SO4°£
(3)…ѕ ц‘™ЋЎ„й≥…µƒЋƒ‘≠„”є≤ЉџїѓЇѕќпµƒµз„” љ£Ї![]() (їт
(їт![]() їт
їт![]() µ»∆дЋыЇѕјнір∞ЄЊщњ…)°£
µ»∆дЋыЇѕјнір∞ЄЊщњ…)°£
(4)eµƒµ•÷ ‘Џ„гЅњd2÷–»Љ…’Јі”¶µƒїѓ—ІЈљ≥ћ љ£Ї2Na £ЂO2 ![]() Na2O2°£
Na2O2°£
(5)R «NH4Al(SO4)2£ђЌЉ÷–“јіќЈҐ…ъЈі”¶£ЇAl3++3OH£≠![]() Al(OH)3°э°Ґ
Al(OH)3°э°Ґ![]() +OH£≠
+OH£≠![]() NH3°§H2O°ҐAl(OH)3+OH£≠
NH3°§H2O°ҐAl(OH)3+OH£≠![]()
![]() +2H2O°£
+2H2O°£
ҐўmµгЈі”¶µƒјл„”Јљ≥ћ љ£Ї![]() +OH£≠
+OH£≠![]() NH3°§H2O°£
NH3°§H2O°£
ҐЏѕыЇƒNaOH0.05mol£ђ0.024molBa(OH)2Їђ”–0.048molOH£≠ЇЌ0.024molBa2+£ђ0.01molRЇђ”–0.02mol![]() °£Ba(OH)2ћбє©µƒOH£≠±»NaOHЉх…ў0.002mol£ђЈі”¶Al(OH)3+OH£≠
°£Ba(OH)2ћбє©µƒOH£≠±»NaOHЉх…ў0.002mol£ђЈі”¶Al(OH)3+OH£≠![]()
![]() +2H2O“тќ™Љх…ў0.002 molOH£≠ґш £”а0.002mol Al(OH)3£ђЈі”¶Ba2++
+2H2O“тќ™Љх…ў0.002 molOH£≠ґш £”а0.002mol Al(OH)3£ђЈі”¶Ba2++![]()
![]() BaSO4°э÷–µƒ
BaSO4°э÷–µƒ![]() ≤ї„г£ђBaSO4µƒќп÷ µƒЅњµ»”Џ
≤ї„г£ђBaSO4µƒќп÷ µƒЅњµ»”Џ![]() µƒќп÷ µƒЅњќ™0.02mol£ђ≥Ѕµнµƒќп÷ µƒЅњќ™0.022mol°£
µƒќп÷ µƒЅњќ™0.02mol£ђ≥Ѕµнµƒќп÷ µƒЅњќ™0.022mol°£

°Њћвƒњ°њѕ¬±н «‘™ЋЎ÷№∆Џ±нµƒ“ї≤њЈ÷£ђ’лґ‘±н÷–µƒҐў°ЂҐв÷–‘™ЋЎ£ђ”√‘™ЋЎЈыЇ≈їтїѓ—І љћоњ’їЎір“‘ѕ¬ќ ћв£Ї
÷ч„е ÷№∆Џ | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
ґю | Ґў | ҐЏ | ||||||
»э | Ґџ | Ґ№ | ҐЁ | Ґё | Ґя | Ґа | ||
Ћƒ | Ґб | Ґв |
£®1£©‘Џ’в–©‘™ЋЎ÷–£ђљр ф–‘„о«њµƒ‘™ЋЎ «_______£ђ„оїо∆√µƒЈ«љр ф‘™ЋЎ «_______£ї
£®2£©їѓ—І–‘÷ „о≤їїо∆√µƒ‘™ЋЎ «__________£ђ∆д‘≠„”µƒ‘≠„”љбєє Њ“вЌЉќ™_____________£ї
£®3£©‘™ЋЎµƒ„оЄяЉџ—хїѓќпґ‘”¶µƒЋЃїѓќп÷–Ћб–‘„о«њµƒ «______________£ђЉо–‘„о«њµƒ «____________£ђ≥ Ѕљ–‘µƒ«в—хїѓќп «____________________£ї
£®4£©Ґџ°ЂҐя‘™ЋЎ÷–£ђ‘≠„”∞лЊґ„оіуµƒ «________£ђ‘≠„”∞лЊґ„о–°µƒ «____________£ї
£®5£©‘ЏҐя”лҐвµƒµ•÷ ÷–£ђїѓ—І–‘÷ љѕїо∆√µƒ «_____________£ђњ…”√ ≤√іїѓ—ІЈі”¶Ћµ√чЄ√ ¬ µ£®–і≥цЈі”¶µƒїѓ—ІЈљ≥ћ љ£©____________________°£
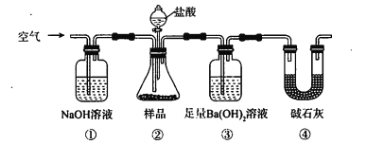
°Њћвƒњ°њќёЋЃЋƒ¬»їѓќэ≥£”√„ч√љ»ЊЉЅЇЌ”–їъЇѕ≥…÷–µƒ¬»їѓіяїѓЉЅ°£ µ—й “њ…”√»џ»Џµƒќэ(»џµг232°ж)”лCl2Јі”¶÷∆±ЄSnCl4£ђ„∞÷√»зЌЉ°£

“—÷™:ҐўSnCl2°ҐSnCl4”–єЎќпјн–‘÷ :
ќп÷ | —’…Ђ°Ґ„іћђ | »џµг/°ж | Ј–µг/°ж |
SnCl2 | ќё…ЂЊІће | 246 | 652 |
SnCl4 | ќё…Ђ“Їће | ©Б33 | 114 |
ҐЏSnCl4ЉЂ“„ЋЃљв…ъ≥…SnO2H2O°£
їЎірѕ¬Ѕ–ќ ћв:
£®1£©µЉє№aµƒ„ч”√ «____________________________________________________________£ђ„∞÷√A÷–ЈҐ…ъЈі”¶µƒјл„”Јљ≥ћ љќ™________________________________________°£
£®2£©µ±єџ≤мµљ„∞÷√F“Ї√ж…ѕЈљ______________ ±≤≈њ™ Љµг»ЉDі¶µƒЊ∆ЊЂµ∆£ђіэќэ»џїѓЇу µ±‘ціу¬»∆шЅчЅњ£ђЉћ–шЉ”»»°£іЋ ±Љћ–шЉ”»»µƒƒњµƒ «____________________________°£
£®3£©»ф…ѕ ц„∞÷√÷–»±…ў„∞÷√C(∆дЋьЊщѕаЌђ)£ђ‘тDі¶Њя÷І ‘є№÷–ЈҐ…ъµƒ÷ч“™Є±Јі”¶їѓ—ІЈљ≥ћ љќ™____________________________________________________________°£
£®4£©Cl2ЇЌќэµƒЈі”¶≤ъќп”–SnCl4ЇЌSnCl2£ђќ™Јј÷є≤ъ∆Ј÷–іш»лєэґаµƒSnCl2£ђњ…≤…»°µƒіл © «____________________________________________________________°£
£®5£©µќґ®Ј÷ќц≤ъ∆Ј÷–2ЉџSn(II)µƒЇђЅњ:”√Ј÷ќцћм∆љ≥∆»°5.000 g≤ъ∆Ј”Џ„ґ–ќ∆њ÷–£ђ”√’фЅуЋЃ»№љв£ђЉ”»лµнЈџ»№“Ї£ђ”√0.1000 molL©Б1µƒµв±к„Љ»№“Їµќґ®÷Ѕ÷’µг ±ѕыЇƒ20.00 mL£ђ‘т≤ъ∆Ј÷–Sn(II)µƒЇђЅњќ™____________________°£
°Њћвƒњ°њЉ„Ќђ—Іјы”√ѕ¬ЌЉЋщ Њ„∞÷√‘Џ µ—й “÷∆±Є““Ћб““х•°£
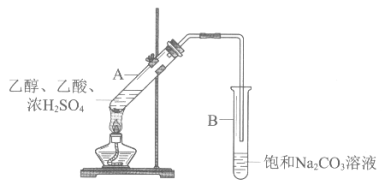
£®1£© µ—й÷–±•ЇЌNa2CO3»№“Їµƒ„ч”√ «_______°£
ƒ≥іќ µ—й ±£ђ‘Џ±•ЇЌNa2CO3»№“Ї÷–µќЉ”2µќЈ”ћ™»№“Ї°£ µ—йљб ш£ђ»°ѕ¬ ‘є№B’сµі£ђЇм…ЂЌ »•°£ќ™ћљЊњЌ …Ђµƒ‘≠“т£ђљш––»зѕ¬ µ—й°£
±аЇ≈ | Ґў | ҐЏ | Ґџ |
µ—й |
|
|
|
≤ў„ч | ≥дЈ÷’сµі°ҐЊ≤÷√ | ≥дЈ÷’сµі°ҐЊ≤÷√ | ≥дЈ÷’сµі°ҐЊ≤÷√°ҐЈ÷“Ї°£»°ѕ¬≤г»№“Ї£ђЉ”»л±•ЇЌNa2CO3»№“Ї |
ѕ÷ѕу | …ѕ≤г“Їће±д±°£ђ√∞∆ш≈Ё£ђѕ¬≤г»№“ЇЇм…ЂЌ »• | …ѕ≤г“Їће≤ї±д±°£ђќё∆ш≈Ё£ђѕ¬≤г»№“ЇЇм…ЂЌ »• |
£®2£© ‘є№Ґў÷–≤ъ…ъ∆ш≈Ёµƒ‘≠“т «£®”√їѓ—ІЈљ≥ћ љљв Ќ£©_______°£
£®3£©ґ‘±» µ—饢ЇЌҐЏњ…µ√≥цµƒљб¬џ «_______°£
£®4£©’лґ‘ µ—饏÷–ѕ÷ѕу£ђ““Ќђ—Іћб≥ц≤¬ѕл£ЇЈ”ћ™Єь“„»№”Џ““Ћб““х•°£ µ—饟÷–єџ≤мµљ_______£ђ÷§ µ““µƒ≤¬ѕл’э»Ј°£