题目内容
【题目】甲同学利用下图所示装置在实验室制备乙酸乙酯。
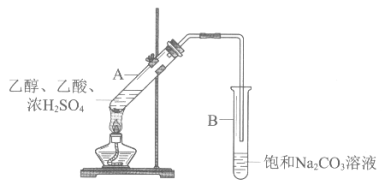
(1)实验中饱和Na2CO3溶液的作用是_______。
某次实验时,在饱和Na2CO3溶液中滴加2滴酚酞溶液。实验结束,取下试管B振荡,红色褪去。为探究褪色的原因,进行如下实验。
编号 | ① | ② | ③ |
实验 |
|
|
|
操作 | 充分振荡、静置 | 充分振荡、静置 | 充分振荡、静置、分液。取下层溶液,加入饱和Na2CO3溶液 |
现象 | 上层液体变薄,冒气泡,下层溶液红色褪去 | 上层液体不变薄,无气泡,下层溶液红色褪去 |
(2)试管①中产生气泡的原因是(用化学方程式解释)_______。
(3)对比实验①和②可得出的结论是_______。
(4)针对实验②中现象,乙同学提出猜想:酚酞更易溶于乙酸乙酯。实验③中观察到_______,证实乙的猜想正确。
【答案】中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O下层溶液红色褪去的原因与乙酸无关溶液不变红或无明显现象
【解析】
(1)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,故答案为:中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度;(2)试管①中乙酸乙酯中的乙酸与碳酸钠反应,产生气泡,发生的反应为2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O;(3)对比实验①和②,无论有没有含乙酸,溶液红色均褪去,可得出的结论是下层溶液红色褪去的原因与乙酸无关;(4)针对实验②中现象,上层液体不变薄则乙酸乙酯不溶解于下层碳酸钠溶液且不与碳酸钠反应而无气泡,下层溶液红色褪去是因为酚酞被萃取于乙酸乙酯中碳酸钠溶液中不再含有酚酞而显无色,故乙同学提出猜想:酚酞更易溶于乙酸乙酯。实验③中充分振荡、静置、分液。取下层溶液,下层溶液中已不含酚酞,故加入饱和Na2CO3溶液观察到溶液不变红或无明显现象,证实乙的猜想正确。

【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)
PbCl42-(aq)
不同温度下PbCl2的溶解度如下表所示:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是________________________________。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是__________________________________________________________。
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方塑式为2NO(g) + Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____( 填增大、减少、不变).
(2)己知几种化学键的键能数据如下表( 亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl一Cl | Cl一N | N=O |
键能/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol,则a=_______。
2ClNO(g) △H=-111kJ/mol,则a=_______。
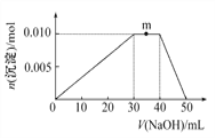
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
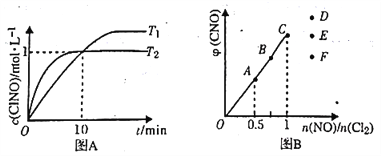
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________mol/(L.min).
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___点,当n(NO)/n(Cl2)=1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______点。