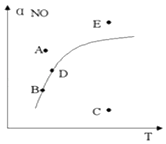
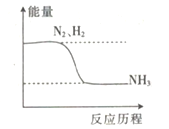
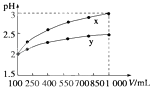
题目内容
【题目】硼及其化合物在工农业生产中应用广泛.
(1)基态硼原子的核外电子排布式为 , 有种不同能量的电子.
(2)BF3溶于水后.在一定条件下可转化为H3O+[B(OH)F3]﹣ , 该物质中阳离子的空间构型为 , 阴离子的中心原子轨道采用杂化.
(3)与BH4﹣互为等电子休的分子是(写化学式).
(4)EminBF4的熔点为12℃,在常温下为液体,由有机物阳离子[Emin]+和[BF4]﹣构成.该物质的晶体属于晶体.
(5)一种由硼和钐(Sm)形成的晶体的晶胞结构如图所示,已知晶胞常数a=n pm,则晶体的密度为gcm﹣3(设NA为阿伏伽德罗常数的值). 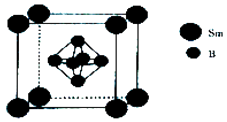
【答案】
(1)1s22s22p1;3
(2)三角锥形;sp3
(3)CH4(或SiH4)
(4)离子
(5)![]()
【解析】解:(1)硼原子核外电子数为5,基态原子核外电子排布为1S12S22P1 , 不同能级上的电子具有不同的能量,故氮原子核外有3种不同能量的电子,所以答案是:1s22s22p1;3;(2)H3O+中O原子价层电子对个数=3+ ![]() (6﹣1﹣3×1)=4且含有一个孤电子对,所以为三角锥形结构,阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式, 所以答案是:三角锥形;sp3;(3)根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,BH4﹣离子中有5个原子,价电子数为8,所以与BH4﹣离子互为等电子体的一种分子为CH4、SiH4等,所以答案是:CH4(或SiH4);(4)EminBF4由有机物阳离子[Emin]+和[BF4]﹣构成,由离子构成的化合物属于离子化合物,所以答案是:离子;(5)该晶胞中Sm原子个数为8×
(6﹣1﹣3×1)=4且含有一个孤电子对,所以为三角锥形结构,阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式, 所以答案是:三角锥形;sp3;(3)根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,BH4﹣离子中有5个原子,价电子数为8,所以与BH4﹣离子互为等电子体的一种分子为CH4、SiH4等,所以答案是:CH4(或SiH4);(4)EminBF4由有机物阳离子[Emin]+和[BF4]﹣构成,由离子构成的化合物属于离子化合物,所以答案是:离子;(5)该晶胞中Sm原子个数为8× ![]() =1、B原子个数6,M=(150+6×11)g/mol=216g/mol,晶胞常数a=n pm,该晶体密度ρ=
=1、B原子个数6,M=(150+6×11)g/mol=216g/mol,晶胞常数a=n pm,该晶体密度ρ= ![]() =
= 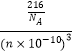 =
= ![]() gcm﹣3 , 所以答案是:
gcm﹣3 , 所以答案是: ![]() .
.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 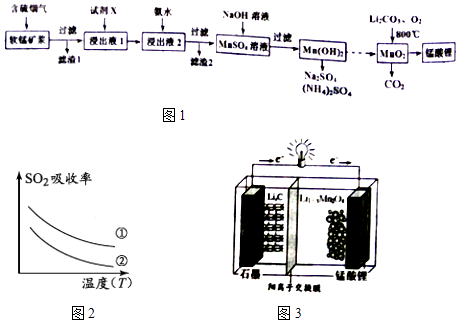
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | CCl4,萃取 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Fe | Cu | 稀硫酸,过滤 |
D | CaCO3 | CaO | 稀盐酸,过滤 |
A. A B. B C. C D. D