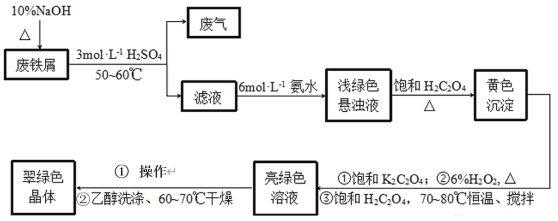
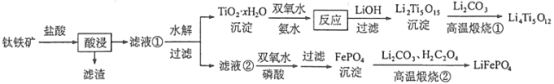
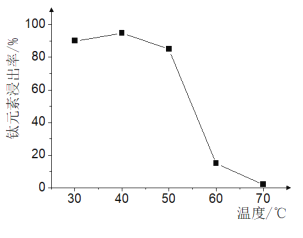
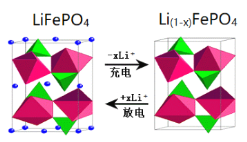
题目内容
【题目】下列关于有机化合物的说法正确的是( )
A.2-甲基丁烷也称异丁烷
B.C4H9Cl有3种同分异构体
C.正丁烷的4个碳原子可以在同一直线上
D.甲烷、乙烷、丙烷的结构都只有一种
【答案】D
【解析】
A. 2-甲基丁烷也称异戊烷,A错误;
B. C4H9Cl有C-C-C-C、和![]() 两种碳链结构,这两种碳链结构分别有两种不同位置的H原子,其中的H原子被Cl原子取代,都会产生2种同分异构体,则C4H9Cl有4种同分异构体,B错误;
两种碳链结构,这两种碳链结构分别有两种不同位置的H原子,其中的H原子被Cl原子取代,都会产生2种同分异构体,则C4H9Cl有4种同分异构体,B错误;
C.正丁烷中的C原子都是饱和C原子,与饱和C原子连接的四个原子构成的是四面体结构,所以正丁烷分子中的4个碳原子不可能在同一直线上,C错误;
D.甲烷是正四面体结构,四个H原子位置相同,所以不存在同分异构体;乙烷可看作是甲烷分子中的一个H原子被-CH3取代产生的物质,不存在同分异构体;丙烷分子可看作是甲烷分子中的2个H原子被-CH3取代产生的物质,不存在同分异构体,所以甲烷、乙烷、丙烷的结构都只有一种,D正确;
故合理选项是D。

练习册系列答案
相关题目