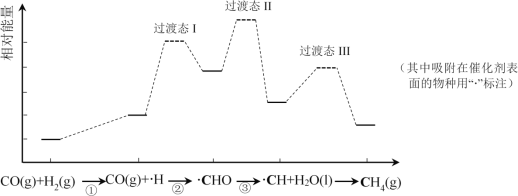
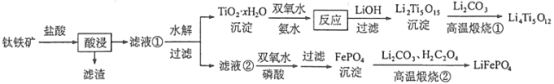
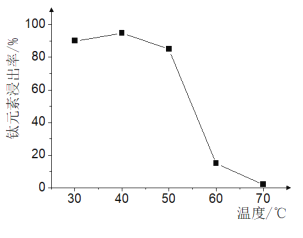
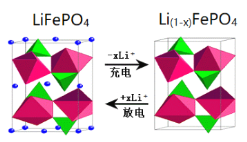
题目内容
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为n![]() +(n+1)HO(CH2)4OH
+(n+1)HO(CH2)4OH![]()
![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.![]() 的沸点高于
的沸点高于![]()
B.高分子材料PU在强酸、强碱条件下能稳定存在
C.合成PU的两种单体的核磁共振氢谱中均有3组吸收峰
D.以1,![]() 丁二烯为原料,可合成
丁二烯为原料,可合成![]()
【答案】B
【解析】
A.C原子数相同时含羟基的有机物易形成氢键,沸点高,则![]() 的沸点高于
的沸点高于![]() ,故A不符合题意;
,故A不符合题意;
B.PU的结构中![]() ,酸性、碱性条件下均可发生水解反应,故不能稳定存在,故B符合题意;
,酸性、碱性条件下均可发生水解反应,故不能稳定存在,故B符合题意;
C.两种单体中均含3种不同化学环境的H原子,则两种单体的核磁共振氢谱中均有3组吸收峰,故C不符合题意;
D.以1,3-丁二烯为原料,先与溴发生1,4-加成,再与氢气加成,后发生卤代烃的水解反应可生成![]() ,故D不符合题意;
,故D不符合题意;
故答案为:B。

练习册系列答案
相关题目