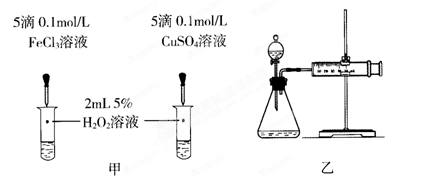
题目内容
2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下: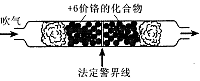
金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:
当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
| A.反应中发生转移的电子个数为3nx |
| B.该废水中c(Cr2O2-7)为50nx mol/L |
| C.消耗硫酸亚铁铵的物质的量为n(l+y)mol |
| D.在FeO·FeyCrxO3中,x+y=2 |
(14分)
(1)Cr2O2-7;灰绿色;3C2H5OH+2 Cr2O2-7 +16H+ =3CH3COOH+4 Cr3+ +11H2O;
(2)①电解时阴极消耗H+,Cr2O2-7还原为Cr3+ 也消耗H+,所以pH不断上升;
②3.7<pH< 8.5;③0.25 mol;④A
解析试题分析:
(1)因为在强酸性溶液中;2CrO42-+2H+ Cr2O72-+H2O平衡向右移动;
Cr2O72-+H2O平衡向右移动;
Cr2O2-7与C2H5OH反应生成Cr3+ 所以呈灰绿色;
根据氧化还原反应配平得 3C2H5OH+2 Cr2O2-7 +16H+ =3CH3COOH+4 Cr3+ +11H2O;
(2)①电解时阴极的电极反应方程式为2H+ +2e=H2另外溶液中还发生Cr2O72- +6 Fe2++14 H+ = 2Cr3+
+6 Fe3+ +7 H2O
②3.7<pH<8.5,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀;
③当电路中通过3mol电子时,会产生1.5mol Fe2+ ,再根据Cr2O72- +6 Fe2++14 H+ = 2Cr3+ +6 Fe3+ +7 H2O还原的Cr2O72- 为0.25mol;
④反应中发生转移的电子个数为ny;
考点:本题以探究实验为基础,考察学生对氧化还原反应的掌握情况。

 阅读快车系列答案
阅读快车系列答案用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3?3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是______________________;
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成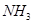 ,写出反应的离子方程式____________________________;
,写出反应的离子方程式____________________________;
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用离子方程式和简要文字表述):
__________________________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol?Lˉ1NaOH溶液、8.0 mol?Lˉ1NaOH溶液、澄清石灰水、0.01 mol?Lˉ1KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是_____; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | |
(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。发生的反应如下: 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/g·cm-3 | 水中溶解性 |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将Na2Cr2O7溶液与浓硫酸混合液放置在B中。在A中加入正丁醇和几粒沸石,加热,保持反应温度为90~95℃,在E中收集90℃以上的馏分。
将馏出物倒入分液漏斗中,除去水层,有机层干燥后蒸馏,收集75~77℃馏分。
回答下列问题:
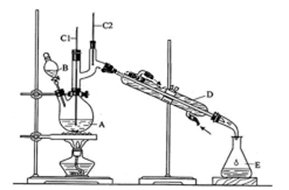
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(3)温度计的作用分别是C1 ;C2 。
(4)将正丁醛粗产品置于分液漏斗中水在 层(填“上”或“下”)。
(5)反应温度应保持在90~95℃,其原因是 。
下列广告语对应商品中含有的物质有误的是
| A.“红梅味精,领先(鲜)一步 ”——蛋白质 |
| B.“衡水老白干,喝出男人味”——乙醇 |
| C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙 |
| D.“要想皮肤好,早晚用大宝”——丙三醇 |
下列说法正确的是
| A.装饰材料中的甲醛和芳香烃会造成居室污染 |
| B.石蜡油分解产生的气体不能使酸性高锰酸钾溶液褪色 |
| C.分子组成为CH2Cl2和C2H6O的有机物都存在同分异构现象 |
| D.油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都能发生水解反应 |
1 L水中溶有Mg(HCO3)2和CaCl2的浓度分别是b mol·L-1和2b mol·L-1,现用一种试剂(适量)把Ca2+、Mg2+除去,这种试剂最好选用 ( )。
| A.Ca(OH)2 | B.NaOH | C.NaHCO3 | D.Na2CO3 |