题目内容
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程。其设计的模拟装置如下:
根据要求填空:
(1)B装置有三种功能:①均匀混合气体;② ;③ 。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应 。
(3)D装置的石棉中均匀混有KI粉末,其作用是 。
(4)E装置的作用是 (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 (填分离方法名称)。
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4;B.CH3Cl;C.CH2C12;D.CHCl3;E.CCl4
(1)干燥气体、控制气流速度
(2)x≥4
(3)吸收过量的Cl2
(4)CD
(5)分液
(6)AB
解析

 名校课堂系列答案
名校课堂系列答案2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下: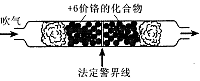
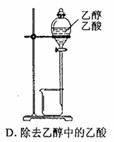
金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:
当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
| A.反应中发生转移的电子个数为3nx |
| B.该废水中c(Cr2O2-7)为50nx mol/L |
| C.消耗硫酸亚铁铵的物质的量为n(l+y)mol |
| D.在FeO·FeyCrxO3中,x+y=2 |





 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+




