题目内容
下图中的实验装置可以用于实验室制取乙炔。请填空:
(1) 图中A管的作用是 ,
制取乙炔的化学反应方程式为 。
(2)乙炔通入酸性KMnO4溶液中,发生 反应,可以观察到
现象,若通入溴水中,发生 反应。
(3)乙炔燃烧的化学方程式为 ,燃烧时的现象为 ,
为了安全,点燃乙炔前应该先 。
(1)调节水面的高度来控制反应的发生和停止
CaC2+H2O Ca(OH)2+
Ca(OH)2+ ↑(2)氧化 紫色酸性高锰酸钾溶液逐渐褪色 加成
↑(2)氧化 紫色酸性高锰酸钾溶液逐渐褪色 加成
(3)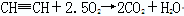 明亮火焰 黑色浓烟 验纯
明亮火焰 黑色浓烟 验纯
解析试题分析:(1) 图中A管是可以上下移动的,所以可以通过调节水面的高度来控制反应的发生和停止。实验室制取乙炔的化学方程式是CaC2+H2O Ca(OH)2+
Ca(OH)2+ ↑。
↑。
(2)乙炔含有碳碳三键,能被酸性高锰酸钾溶液氧化,也能和溴水发生加成反应,所以乙炔通入酸性KMnO4溶液中,发生氧化反应,可以观察到紫色酸性高锰酸钾溶液逐渐褪色;若通入溴水中,发生加成反应。
(3)乙炔是可燃性气体,点燃前相应检验乙炔的纯度。由于乙炔中含碳量高,所以燃烧时有黑色浓烟生成,反应的化学方程式是2HCH2+5O2 4CO2+2H2O。
4CO2+2H2O。
考点:考查乙炔的实验室制备、乙炔的化学性质
点评:该题是基础性试题的考查,难度不大。试题贴近教材,基础性强,旨在巩固学生的基础,提高学生的应试能力。明确乙炔的实验室制备原理、乙炔的结构特点和性质特点,是答题的关键。

 名校课堂系列答案
名校课堂系列答案(5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
回答下列问题:
(1)根据你已有的对乙酸乙酯反应条件的认识,该实验预期可观察到的现象是下图中的 。

(2)该实验对反应温度的控制较为严格,若温度过高时,产生的主要问题是 。
(3)在步骤二中,振荡试管后可观察到液体稍显浑浊,其原因是 。
(4)按所设步骤实验反应速率较慢,其主要原因是 。
(5)在实际操作中,针对(4)中的原因进行改进后,预期的现象仍不明显,有人又将该实验作如下改进
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下: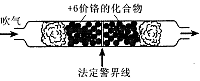
金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:
当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
| A.反应中发生转移的电子个数为3nx |
| B.该废水中c(Cr2O2-7)为50nx mol/L |
| C.消耗硫酸亚铁铵的物质的量为n(l+y)mol |
| D.在FeO·FeyCrxO3中,x+y=2 |
化学与人类生产、生活,社会可持续发展密切相关。下列说法正确的是
| A.蔬菜表面洒少许福尔马林,可保鲜和消毒 |
| B.绿色食品就是不使用化肥农药,不含任何化学物质的食品 |
| C.推广纳米TiO2光触媒技术铺设“生态马路”,将汽车尾气转化为无害物质 |
| D.推广使用煤液化技术可减少二氧化碳温室气体气体的排放 |
食用下列食品通常不会对人体健康造成危害的是 ( )
| A.用甲醛溶液浸泡的海鲜 | B.用工业食盐腌制的泡菜 |
| C.用工业酒精配制的白酒 | D.牛奶经发酵后得到的酸奶 |
化学与生活、社会密切相关。下列有关说法中,错误的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,均不可食用 |
| C.为防止电池中的重金属污染土壤和水体,应积极开发废电池的综合利用 |
| D.减少机动车尾气的排放,可以减少雾霾的发生 |
在医院中,为酸中毒病人输液不应采用( )。
| A.0.9%氯化钠溶液 | B.0.9%氯化铵溶液 |
| C.1.25%碳酸氢钠溶液 | D.5%葡萄糖溶液 |

