题目内容
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3?3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是______________________;
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成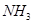 ,写出反应的离子方程式____________________________;
,写出反应的离子方程式____________________________;
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用离子方程式和简要文字表述):
__________________________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol?Lˉ1NaOH溶液、8.0 mol?Lˉ1NaOH溶液、澄清石灰水、0.01 mol?Lˉ1KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是_____; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | |
(18分)(1)用洁净的铂丝蘸取洗涤剂在酒精灯火焰上灼烧,火焰呈黄色(合理即给分)(2分)
(2)H2O2+CNˉ+H2O=HCO3ˉ+NH3(2分)
(3)①2H2O2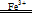 2H2O+O2↑,铁离子会加速H2O2分解,使洗涤剂失去杀菌作用;(3分,方程式2分,后文字描述1分,下②同)
2H2O+O2↑,铁离子会加速H2O2分解,使洗涤剂失去杀菌作用;(3分,方程式2分,后文字描述1分,下②同)
②2Fe3++3CO32ˉ+3H2O=2Fe(OH)3↓+3CO2↑,Fe3+与CO32ˉ水解相互促进水解,使洗涤剂失去去污能力;(同上)
(4)①CO2和O2(2分,气体符号名称顺序可颠倒)
②(共6分)实验操作 预期现象与结论 澄清石灰水、8.0mol?Lˉ1NaOH溶液,并将带火星的木条放在最后一个洗气瓶的出口处。(答案着重号处为各得分点,各1分;试剂(要求浓渡数值单位)选对且顺序准确才给分,试剂顺序颠倒扣2分;) 若澄清石灰水不变浑浊,木条复燃,则假设1成立;(1分)
若澄清石灰水变浑浊,木条复燃,则假设2成立;(1分)
若澄清石灰水变浑浊,木条不复燃,则假设3成立。(1分)
解析试题分析:(1)2Na2CO3?3H2O2中金属阳离子为钠离子,应根据焰色反应检验是否存在Na+,有关操作及现象为:用洁净的铂丝蘸取洗涤剂在酒精灯火焰上灼烧,火焰呈黄色,说明该洗涤剂中存在钠离子;(2)废水中氰化物以CNˉ形式存在,氮元素为—3价,则碳元素为+2价,双氧水具有氧化性,+2价碳元素被氧化为+4价,氧元素由—1价降为—2价,根据电子、电荷、原子守恒可得:H2O2+CNˉ+H2O=NH3↑+HCO3ˉ(注意不能写成H2O2+CNˉ+H2O=NH3↑+CO2↑+OHˉ,因为CO2与OHˉ能继续反应HCO3ˉ,CO2与碳酸钠溶液也能继续反应生成碳酸氢钠);(3)过氧化氢不稳定,能分解为水和氧气,铁离子是该反应的常用催化剂之一,能加快过氧化氢分解的速率,使洗涤剂失去消毒作用;(4)①洗涤剂中过氧化氢在氯化铁溶液催化下分解放出氧气,碳酸钠与氯化铁溶液混合时能发生双水解反应,放出二氧化碳气体;如果混合时只发生前一种反应,则产生的气体是O2;如果混合时只发生后一种反应,则产生的气体是CO2;如果两种反应能同时发生,则产生的气体是O2和CO2;根据提出的假设1和3推断,假设2的内容为气体是O2和CO2;根据元素化合物的主要性质推断,二氧化碳能使澄清石灰水变浑浊,与其余试剂都无明显变化,二氧化碳不能支持燃烧,而氧气却能使带火星的木条复燃,因此检验O2和CO2需要考虑先后顺序,排除干扰,应按先检验二氧化碳、再除去过量的二氧化碳、最后检验氧气的顺序进行实验,所以设计的方案为:将反应产生的气体依次通入盛有澄清石灰水、8.0mol/LnaOH溶液的洗气瓶中,用带火星的木条检验最后逸出的气体;若澄清石灰水变浑浊、木条复燃,则假设2成立;若澄清石灰水不变浑浊、木条复燃,则假设1成立;若澄清石灰水变浑浊、木条不复燃,则假设3成立(注意不能选择0.10mol/LNaOH溶液,因为除杂试剂一定过量,应选浓溶液除杂)。
考点:考查元素化合物的主要性质和化学实验方案的设计,涉及钠元素的检验方法、氧化还原反应、书写离子方程式、解释原因、提出合理假设、二氧化碳和氧气的检验等。

 名校课堂系列答案
名校课堂系列答案2012年10月8日发布的修订版《机动车驾驶证申领和使用规定》,以其对违章驾驶员的严厉惩罚被人们称为“史上最严交规”,其中饮酒后驾驶机动车的一次记12分。利用如下测试管可检测司机是否酒后驾车,化学原理如下: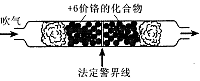
金属铬在化合物中主要有+3价和+6价两种价态。+6价铬化合物K2CrO4和K2Cr2O7在水溶液中分别呈黄色和橙色,它们在溶液中存在如下平衡关系:2CrO42-+2H+ Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
Cr2O72-+H2O在酸性条件下+6价铬化合物具有强氧化性,可以将C2H5OH氧化为CH3COOH,本身被还原为Cr3+,Cr3+在水溶液中呈灰绿色。
(1)根据上述条件可知,在强酸性条件下+6价铬主要以 (填“CrO2-4”或“Cr2O2-7”)形式存在。如果司机酒后驾车,则测试管中的现象是 且超过法定警界线,反应的离子方程式为 。
(2)研究发现+6价铬的毒性为+3价铬的毒性的100~200倍,有多种方法可以将废水中的+6价铬转化为+3价铬以降低毒性。其中两种方法如下:
方法一:电化学方法。将含Cr2O2-7的酸性废水加适量NaCl搅拌均匀并以Fe作电极进行电解。在阳极产生的Fe2+将Cr2O2-7还原为Cr3+,在电解过程中溶液的pH不断上升,最终Cr3+和Fe3+以Cr(OH)3和Fe(OH)3沉淀的形式析出。
①请分析溶液pH不断上升的原因: 。
②已知Fe3+和Cr3+变为Fe(OH)3和Cr(OH)3沉淀的pH如下表:
当溶液的pH范围为____时,溶液中Fe3+已沉淀完全而Cr3+还没有开始沉淀。
③当电路中通过3mol电子时,理论可还原Cr2O2-7的物质的量为 mol。
方法二:还原沉淀法。将l0ml某含铬(Cr2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀经干燥后为nmolFeO·FeyCrxO3。
④不考虑处理过程中的实际损耗,下列叙述错误的是
| A.反应中发生转移的电子个数为3nx |
| B.该废水中c(Cr2O2-7)为50nx mol/L |
| C.消耗硫酸亚铁铵的物质的量为n(l+y)mol |
| D.在FeO·FeyCrxO3中,x+y=2 |
化学与生产、生活、社会密切相关。下列说法中不正确的是( )
| A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。 |
| B.绿色化学的核心是从源头上消除工业生产对环境的污染。 |
| C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。 |
| D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。 |








 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。


