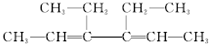
题目内容
7.若由NH3制NO的转化率为94%,NO转化为HNO3的转化率为95%.现以amol NH3 和足量空气为原料(不考虑N2的反应,末转化的NH3和NO也未进入后续变化中)最大程度制取NH4N03,经过一系列转化反应丼恢复至室温,向反应后的混合物中加入m g水,得到密度为P g•mL-1的NH4N03溶液,计算溶液中NH4N03物质的量浓度.分析 设制备硝酸的氨气为xmol,则与硝酸反应氨气为(a-x)mol,根据氮原子守恒可知:NH3~NO~HNO3,将每一步转化率都转化为氨气的利用率,表示出生成硝酸的物质的量,由HNO3+NH3═NH4NO3可知,与硝酸反应的氨气物质的量等于硝酸的物质的量,据此列方程计算x的值,进而计算生成NH4NO3的物质的量,根据V=$\frac{m}{ρ}$计算溶液的体积,再根据c=$\frac{n}{V}$计算溶液中NH4NO3物质的量浓度.
解答 解:设制备硝酸的氨气为xmol,则与硝酸反应氨气为(a-x)mol,
由NH3~NO~HNO3,可知xmol氨气可得到硝酸xmol×94%×95%=0.893x mol
由HNO3+NH3═NH4NO3,则该反应消耗的氨气与硝酸的物质的量相等,故0.893x mol=(a-x)mol,解得x=$\frac{a}{1.893}$,故生成NH4NO3为0.893x mol=$\frac{0.893a}{1.893}$mol,
则溶液质量=mg+$\frac{0.893a}{1.893}$mol×80g/mol=(m+$\frac{71.44a}{1.893}$)g,
故溶液体积V=$\frac{(m+\frac{71.44a}{1.893})g}{1000P/L}$=$\frac{1.893m+71.44a}{1893P}$L,
故溶液中NH4NO3物质的量浓度为$\frac{\frac{0.893a}{1.893}mol}{\frac{1.893m+71.44a}{1893P}L}$=$\frac{893aP}{1.893m+71.44a}$mol/L,
答:溶液中NH4NO3物质的量浓度为$\frac{893aP}{1.893m+71.44a}$mol/L.
点评 本题考查多步反应有损失率的计算、物质的量浓度计算,属于字母型计算,增大计算难度,属于易错题目,注意利用关系式解答,难度中等.

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | 石蕊 | B. | 硝酸银 | C. | 亚硫酸钠 | D. | 氯化铝 |
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
| A. | ②③ | B. | ④⑥⑦ | C. | ①④⑥⑦ | D. | ②③⑤⑦ |
| A. | 11g | B. | 17g | C. | 44g | D. | 22g |
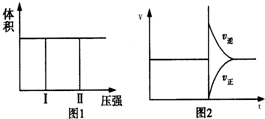
| A. | 若把2molX和1 molY充入该容器时,处于状 态Ⅰ,达到平衡时处于状态Ⅱ(如图1所示),则该反应的正反应是吸热反应 | |
| B. | 若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,Z的物质的量仍为 p mol,则W的起始物质的量n(W)应满足的条件是n(W)>(1-0.5p) mol | |
| C. | 反应达到平衡后,再将2molX和1 molY充入该容器中,则反应速率V与时间t关系图如图2所示 | |
| D. | 若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的密度未发生改变 |
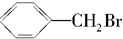 的说法不正确的是( )
的说法不正确的是( )| A. | 所有的碳原子在同一个平面上 | |
| B. | 能够发生加成反应 | |
| C. | 不能发生消去反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |