题目内容
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
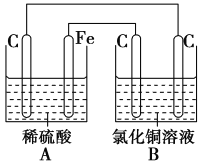
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D.经过一段时间,B烧杯中溶液的浓度减小
【答案】B
【解析】
A中Fe、C、稀硫酸构成原电池,A、B相连,A装置为B装置提供电能,所以B为电解池,A中发生反应为Fe+2H+=Fe2++H2↑,B中为惰性电极电解氯化铜溶液,发生反应CuCl2![]() Cu+Cl2↑,据此解答。
Cu+Cl2↑,据此解答。
A. A中Fe、C、稀硫酸构成原电池,A、B相连,A装置为B装置提供电能,所以B为电解池,A项正确;
B. 由A项分析知,A为原电池,B为电解池,B项错误;
C. A中C上有氢气生成,其电极反应式为:2H++2e-=H2↑,当A烧杯中产生0.1mol气体时,转移0.2mol电子,B中阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2↑,当转移0.2mol电子时,生成氯气为0.1mol,所以A和B中生成气体的物质的量相同,C项正确;
D. B中为惰性电极电解氯化铜,所以一段时间后,B烧杯中溶液的浓度会减小,D项正确;
答案选B。

练习册系列答案
相关题目
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
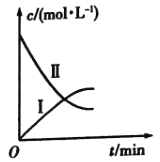
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快