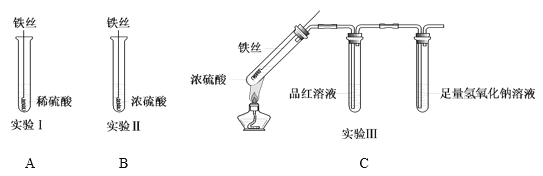
题目内容
【题目】【化学-选修3:物质结构与性质】
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E2+原子核外有3层电子且M层3d轨道电子半满。请回答下列问题:
(1)A元素位于周期表_____区,CD3-的空可构型为_____,中心C原子的杂化方式为______。
(2)第一电离能C>D的原因是__________________。
(3)下列表述中能证明D元素比氟元素电负性弱这一事实的是______。
A.常温下氟气的颜色比D单质的颜色深
B. 氟气与D的氢化物剧烈反应,产生D单质
C. 氟与D形成的化合物中D元素呈正价态
D.比较两元素单质与氢气化合时得电子的数目
(4)黄血盐是一种配合物,其化学式为K4[E(CN)6]·3H2O,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________________。
(5).铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为_____;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是______________。
【答案】 S 平面三角形 sp2 N原子最外层为2s22p3,p轨道半满,更稳定,电离能更大 B、C K4[Fe(CN)6]+6H2SO4+6H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑ 5NA 异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑ 5NA 异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键
【解析】(1).A原子所处的周期数、族序数都与其原子序数相等,则A为H元素,出于元素周期表S区;B原子核外电子s轨道电子数是p轨道电子数的两倍,则B为C元素,D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为O元素,C为N元素。NO3-的N原子与3个O原子各共用1对电子,没有孤对电子,所以其空间构型为平面三角形;N原子采用sp2杂化轨道与3个O原子形成σ键;
(2). N原子最外层为2s22p3,O原子最外层为2s22p4,O元素2P轨道有一对成对电子,相对于N原子的半满结构,第一电离能会略小;
(3).A. 二者都为分子晶体,单子颜色的深浅主要由相对分子质量大小控制,A错误。B. 氟气与O元素的氢化物剧烈反应,产生O单质,证明,F能够将O从其氢化物中置换出来,证明F的非金属性较强,B正确。C. 氟与O形成的化合物中O元素呈正价态,证明F得电子能力大于O,故F的非金属性较强,C正确。D. 两元素的单质与氢气化合时的难易程度,或得到氢化物的稳定程度可比较非金属性强弱,与得电子数目无关,D错误。故选择BC。
(4). E2+原子核外有3层电子且M层3d轨道电子半满,则E核外电子排布为 1s22s22p63s23p63d64s2, E为26号元素Fe。黄血盐溶液与稀硫酸加热时发生非氧化还原反应所以反应前后各元素的化合价均不发生变化,与CN - 是等电子体的气态化合物常见的是一氧化碳,所以反应的化学方程式为反应物为K4[Fe(CN)6]+6H2SO4+6H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。
(5). (SCN) 2分子结构式为N≡C-S-S-C≡N,每个C≡N含有1个σ键和两个π键,所以1mol (SCN)2分子中含有σ键的数目为5NA;异硫氰酸分子中N原子连接有H原子,分子间能形成氢键,故沸点高。

【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D