题目内容
3.下列各组表述中,两个微粒不属于同种元素原子的是( )| A. | M层全充满而N层为4s1的原子和位于第四周期第IB族的原子 | |
| B. | 价电子排布为4s1的原子和原子序数为19的原子 | |
| C. | 2p能级有一个空轨道的基态原子和最外层电子数是次外层电子数三倍的原子 | |
| D. | 3p能级有两个空轨道的基态原子和M层电子数为3的原子 |
分析 A.M层全充满而N层为4s1的原子的核外电子排布为1s22s22p63s23p63d104s1;
B.价电子排布为4s1的原子的核外电子排布为1s22s22p63s23p64s1;
C.2p能级有一个空轨道的基态原子,该原子2p能级有2个电子;最外层电子数是次外层电子数三倍的原子为氧;
D.3p能级有两个空轨道的基态原子,该原子3p能级有1个电子;M层电子数为3的原子为铝.
解答 解:A.M层全充满而N层为4s1的原子的核外电子排布为1s22s22p63s23p63d104s1,为铜位于第四周期第IB族的原子,故A不选;
B.价电子排布为4s1的原子的核外电子排布为1s22s22p63s23p64s1,是K,原子序数为19,故B不选;
C.2p能级有一个空轨道的基态原子,该原子2p能级有2个电子,是C,最外层电子数是次外层电子数三倍的原子为氧,不属于同种元素原子,故C选;
D.3p能级有两个空轨道的基态原子,该原子3p能级有1个电子,是Al,M层电子数为3的原子也是Al,故D不选;
故选C.
点评 本题考查核外电子排布规律,侧重于原子结构与元素种类的判断,注重学生的分析能力的考查,注意把握原子核外电子排布特点,难度不大.

练习册系列答案
相关题目
14.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是探究温度对H2O2分解速率的影响,实验①分别向两支试管中加入等量的H2O2溶液的目的是控制变量,
实验中滴加2滴FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
(2)实验①的目的是探究温度对H2O2分解速率的影响,实验①分别向两支试管中加入等量的H2O2溶液的目的是控制变量,
实验中滴加2滴FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
11.X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
| A. | 一定是离子化合物 | |
| B. | R 一定是共价化合物 | |
| C. | R可能是液态物质,也可能是固态物质 | |
| D. | R可能是共价化合物,也可能是离子化合物 |
18.对于淀粉和纤维素这两种物质,下列说法正确的是( )
| A. | 二者都能水解,且水解的最终产物相同 | |
| B. | 它们都可用(C6H10O5)n表示,所以二者互为同分异构体 | |
| C. | 它们均属于糖类,都具有甜味,且都是高分子化合物 | |
| D. | 淀粉能发生银镜反应,而纤维素不能,但能发生酯化反应 |
8.图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
请回答下列问题:
(1)写出E元素的离子结构示意图 ;
;
(2)X的值应为C(填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
| 元素编号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出E元素的离子结构示意图
 ;
;(2)X的值应为C(填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
12.一定条件下,将A、B、C三种气体各1mol通入一个密闭容器中发生反应,2A+B?2C,达到化学平衡时,B的物质的量可能是( )
| A. | 1.5mol | B. | 1mol | C. | 0mol | D. | 0.5mol |
15.下列说法不正确的是( )
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 蛋白质溶液遇醋酸铅溶液发生盐析 | |
| C. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应 | |
| D. | 乙二醇、甲醛、α-羟基丙酸(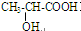 )都可发生缩聚反应 )都可发生缩聚反应 |
 ,
, ,若分子中的两个氢原子被溴原子取代后有多种对称产物,如
,若分子中的两个氢原子被溴原子取代后有多种对称产物,如
 、
、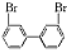 、
、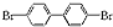 ;
;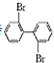 与
与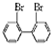 的相互关系是B.
的相互关系是B.