题目内容
8.图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):| 元素编号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出E元素的离子结构示意图
 ;
;(2)X的值应为C(填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
分析 同周期短周期元素中,A有+7、-1价,为ⅦA族元素,A是Cl元素;B有-2、+6价,处于VIA族,B为S元素;C有-3、+5价,处于VA族,故C为P元素;D只有+3价,为ⅢA族元素,所以D是Al元素;E最高正价为+1,处于IA族,故E为Na.
(1)Na+离子质子数为11,核外电子数为10,有2个电子层,各层电子数为2、8;
(2)同周期自左而右电负性增大;
(3)同周期元素的原子半径越小,电负性越大;
(4)元素非金属性越强,氢化物越稳定;
(5)A、D最高价氧化物对应水化物分别为HClO4、Al(OH)3,二者反应生成Al(ClO4)3与水;
(6)D、E最高价氧化物对应水化物分别为Al(OH)3、NaOH,二者反应生成偏铝酸钠与水.
解答 解:同周期短周期元素中,A有+7、-1价,为ⅦA族元素,A是Cl元素;B有-2、+6价,处于VIA族,B为S元素;C有-3、+5价,处于VA族,故C为P元素;D只有+3价,为ⅢA族元素,所以D是Al元素;E最高正价为+1,处于IA族,故E为Na.
(1)Na+离子质子数为11,核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)同周期自左而右电负性增大,P的电负性介于Al与硫之间,即介于1.5~2.5之间,故选:C;
(3)同周期元素的原子半径越小,电负性越大,故答案为:同周期元素的原子半径越小,电负性越大;
(4)非金属性Cl>S>P,元素非金属性越强,氢化物越稳定,故氢化物稳定性:HCl>H2S>PH3,故答案为:HCl>H2S>PH3;
(5)A、D最高价氧化物对应水化物分别为HClO4、Al(OH)3,二者反应生成Al(ClO4)3与水,反应方程式为:Al(OH)3+3HClO4═Al(ClO4)3+3H2O,故答案为:Al(OH)3+3HClO4═Al(ClO4)3+3H2O;
(6)D、E最高价氧化物对应水化物分别为Al(OH)3、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查位置结构性质关系应用,关键是根据化合价及原子半径推断元素,注意对元素周期律的理解掌握.

| A. | 利用地沟油制肥皂的实验中,可以用玻璃棒蘸取反应液滴入有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中的地沟油已完全皂化 | |
| B. | 制备乙酸乙酯时试剂添加的顺序为乙酸、浓硫酸和乙醇,同时为了防暴沸可以添加少量碎瓷片或小火均匀加热 | |
| C. | 可以利用溶液褪色的快慢来判断不同温度下同体积0.10mol•L-1酸性KMnO4溶液与0.01mol•L-1草酸稀溶液反应的快慢 | |
| D. | 燃料电池实验中,用KNO3 溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
| A. | 1.0 mol•L-1的KNO3溶液:H+、Cu2+、I-、SO42- | |
| B. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| C. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| D. | 与铝反应产生大量氢气的溶液:Na+、NH4+、CO32-、NO3- |
| A. |  | B. |  | C. |  | D. |  |
| A. | M层全充满而N层为4s1的原子和位于第四周期第IB族的原子 | |
| B. | 价电子排布为4s1的原子和原子序数为19的原子 | |
| C. | 2p能级有一个空轨道的基态原子和最外层电子数是次外层电子数三倍的原子 | |
| D. | 3p能级有两个空轨道的基态原子和M层电子数为3的原子 |
| A. | 同一反应中,各个物质的反应速率相同 | |
| B. | 反应速率只与物质的量有关 | |
| C. | 同一反应中,各个物质的反应速率可能相同 | |
| D. | 反应速率的符号是Vm |
| A. | 按系统命名法,有机物(CM3)2CHCH(CH2CH3)(CH2CH2CH3)的名称是:2-甲基-3-乙基己烷 | |
| B. |  与 与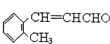 互为同系物 互为同系物 | |
| C. | 一定质量的甲烷、乙烯、乙醇在相同条件下充分燃烧耗氧量相同,则三者的质量大小关系为:乙醇>乙烯>甲烷 | |
| D. | 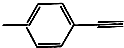 分子中所有原子共平面 分子中所有原子共平面 |
| 选项 | 实验目的 | 试剂 |
| A | 除去Fe2O3中的Al2O3 | 稀盐酸 |
| B | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
| C | 检验溴乙烷中含有溴元素 | 溴乙烷、NaOH溶液、AgNO3溶液 |
| D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |