题目内容
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
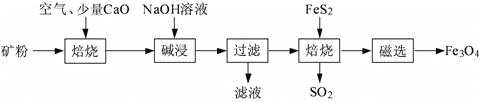
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为:___________________。
(2)“过滤”得到的滤渣中含有大量的Fe2O3。
①不添加CaO的矿粉焙烧时,其中FeS2转化为Fe2O3时发生的化学方程式:____________。
②添加质量分数为1%CaO后,硫元素最终转化为______________。(填化学式)
(3)向“过滤”得到的滤液中通入过量CO2,含铝元素的物质发生转化的离子方程式为_____________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(Fe2O3)∶n(FeS2)=_______。
【答案】SO2+OH =HSO3 4FeS2+11O2![]() 2Fe2O3+8SO2 CaSO4 AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3- 16:1
2Fe2O3+8SO2 CaSO4 AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3- 16:1
【解析】
由流程可知,矿粉焙烧时,矿粉中的FeS2与O2反应生成Fe2O3和SO2,在空气中CaO可将SO2转化为CaSO4;“碱浸”时,Al2O3、SiO2转化为溶于水的NaAlO2、Na2SiO3;Fe2O3和FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2。
(1)SO2属于酸性氧化物,用NaOH溶液吸收过量SO2生成HSO3,则发生反应的离子方程式为:SO2+OH =HSO3;
答案为:SO2+OH =HSO3;
(2).①不添加CaO的矿粉焙烧时,其中FeS2转化为Fe2O3和SO2,发生的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
答案为:4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
②添加质量分数为1%CaO后,SO2与CaO反应生成CaSO3,CaSO3在空气中高温煅烧下又可转化为分解温度较高的CaSO4;
答案为:CaSO4;
(3)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,“过滤”得到的滤液中主要含有AlO2,向“过滤”得到的滤液中通入过量CO2,可以将AlO2转化为Al(OH)3。反应为:AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3- ;
答案为:AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3-;
(4)“过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,设有xmolFe2O3和ymolFeS2完全参加反应,将四氧化三铁中铁元素的化合价看成+![]() ,根据电子得失守恒:2x×(3
,根据电子得失守恒:2x×(3![]() )=2y×5+y×(
)=2y×5+y×(![]() 2),解得
2),解得![]() =16,所以理论上完全反应消耗的n(Fe2O3):n(FeS2)=16:1。
=16,所以理论上完全反应消耗的n(Fe2O3):n(FeS2)=16:1。

 阅读快车系列答案
阅读快车系列答案【题目】X、Y、Z、M、Q、R 是 6 种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)元素 X 在元素周期表中的位置是_____
(2)元素 M 组成的单质的电子式为_____
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为_________________
(4)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_____
(5)元素Q、元素 Z 的含量影响钢铁性能,若钢样中元素 Z 以 FeZ 的形式存在,高温下在过量空气中反应生成ZO2和一种红棕色的氧化物,则反应的化学方程式是_____