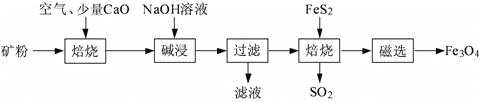
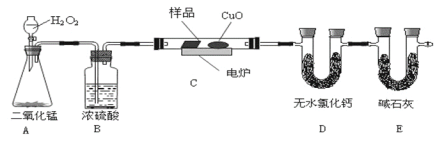
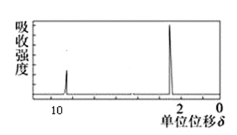
题目内容
【题目】电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
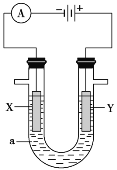
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为__________________,在X极附近观察到的现象是__________________。
②Y电极上的电极反应式为_____________,检验该电极反应产物的方法是______________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①Y电极的材料是_______________,主要的电极反应式为_____________________。
②溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为_______________________,电解池盛放的电镀液可以是__________________________(只要求填一种电解质溶液)。
【答案】2H++2e-=H2↑ 有气体放出,溶液变红 2Cl--2e-=Cl2↑ 把湿润的淀粉碘化钾试纸放在Y电极附近,试纸变蓝色,说明生成了Cl2 纯铜 Cu2++2e-=Cu 变小 Zn2++2e-=Zn ZnCl2(或ZnSO4溶液)
【解析】
(1)①若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
故答案为:2H++2e=H2↑;溶液变红,有气泡产生;
②和电源的正极相连的电极,Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl2e=Cl2↑,氯气可用淀粉碘化钾试纸检验,可使试纸变蓝色,
故答案为:2Cl2e=Cl2↑;把湿润的淀粉碘化钾试纸放在Y电极附近,试纸变蓝色,说明生成了Cl2;
(2)①电解方法精炼粗铜,电解池的X电极是阴极,材料是纯铜,电极反应为:Cu2++2e=Cu,
故答案为:纯铜;Cu2++2e=Cu;
②电解方法精炼粗铜,阴极是Cu2++2e=Cu,阳极上先是金属锌、铁、镍等金属失电子,然后是铜失电子生成铜离子的过程,所以电解后,铜离子浓度是减小的,
故答案为:变小;
(3)如利用该装置实现铁上镀锌,镀件铁是阴极,镀层金属锌是阳极,电极X极即阴极上发生的反应为:Zn2++2e=Zn,电镀液是含有镀层金属阳离子的盐溶液,可以是ZnCl2溶液或是ZnSO4溶液。
故答案为:Zn2++2e=Zn;ZnCl2溶液(或ZnSO4溶液)。

【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解