题目内容
【题目】如图是短元素周期表的一部分,①~⑨是元素周期表中的部分元素。
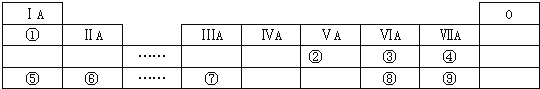
请回答下列问题:
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式);
(2)元素⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是_______________;
(3)元素⑥和⑨形成的化合物的电子式是________________;
(4)③、⑤、⑥形成的简单离子半径由大到小的顺序为_______________(写离子符号);
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂;已知液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式:___________________________;
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
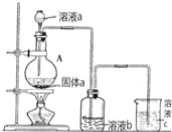
①浓溶液a和溶液b分别为_________、_______(写化学式);
②浓溶液a与黑色固体a反应的离子方程式为_____________________。
【答案】HF Al(OH)3+OH﹣=AlO![]() +2H2O
+2H2O ![]() O2﹣>Na+>Mg2+ N2H4+2H2O2=N2+4H2O 浓HCl Na2S(或H2S) MnO2+4H++2Cl﹣
O2﹣>Na+>Mg2+ N2H4+2H2O2=N2+4H2O 浓HCl Na2S(或H2S) MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【解析】
由元素在周期表中的位置可知,①为H元素、②为N元素、③为O元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为S元素、⑨为Cl元素。结合物质的性质和元素周期律分析解答。
(1)元素的非金属性越强,氢化物越稳定,根据元素周期律,元素③④⑧中非金属性最强的是F元素,所以最稳定的氢化物是HF,故答案为:HF;
(2)Na的最高价氧化物对应的水化物是NaOH,Al的最高价氧化物对应的水化物是Al(OH)3,Al(OH)3与NaOH反应生成NaAlO2与水,反应的离子方程式为Al(OH)3+OH-=![]() +2H2O,故答案为:Al(OH)3+OH-=
+2H2O,故答案为:Al(OH)3+OH-=![]() +2H2O;
+2H2O;
(3)活泼非金属与活泼金属易形成离子化合物,故Cl与Mg形成离子化合物氯化镁,氯化镁的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4) O、Na、Mg的简单离子具有相同的电子层结构,Al核电荷数最大,离子半径最小,O的核电荷数最小,离子半径最大,所以简单离子的半径由大到小的顺序为:O2->Na+>Mg2+,故答案为:O2->Na+>Mg2+;
(5) 由表中两种元素形成的氢化物A和B都含有18个电子, A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,则B是H2O2,液态A与液态B充分反应生成一种液态10电子分子为水,和一种气态单质为氮气,二者反应的化学方程式为N2H4+2H2O2=N2+4H2O,故答案为:N2H4+2H2O2=N2+4H2O;
(6)①元素的非金属性越强,其单质的氧化性越强,要证明Cl元素非金属性大于S元素,可以利用氯气氧化硫的化合物生成硫单质即可,实验室常用浓盐酸和二氧化锰加热制取氯气,所以浓溶液a是浓HCl、溶液b是Na2S(或H2S)溶液,故答案为:浓HCl、Na2S(或H2S)溶液;
②浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】反应CO(g)+2H2(g)![]() 2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
组序号 | 1 | 2 | 3 | 4 | |
反应温度/℃ | 225 | 235 | 225 | 235 | |
反应前气体的物质的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
CO | 3.0 | 3.0 | 2.8 | 2.8 | |
H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
平衡时CH3OH的体积分数/% | 4.9 | 8.8 | 36.5 | 50.7 | |
A.该反应的△H>0
B.当容器中压强不变时,反应达到平衡
C.CH3OH含量增大的原因是CO2
D.少量CO2能提高平衡时CH3OH的体积分数
【题目】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL![]() 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下![]()
![]() 时,所得溶液中各离子浓度由大到小的顺序为______
时,所得溶液中各离子浓度由大到小的顺序为______
(2)常温下向一定体积的![]() 醋酸溶液中加水稀释后,下列说法正确的是______.
醋酸溶液中加水稀释后,下列说法正确的是______.
A.溶液中导电粒子的数目减少 ![]() 醋酸的电离程度增大,
醋酸的电离程度增大,![]() 亦增大
亦增大
C.溶液中 不变
不变 ![]() 溶液中
溶液中 减小
减小
(3)①常温下将![]() 稀硫酸
稀硫酸![]() 与
与![]() NaOH溶液
NaOH溶液![]() mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则![]() :
:![]() ______
______![]() 溶液体积变化忽略不询.
溶液体积变化忽略不询.
②常温下若溶液由![]() 的HA溶液
的HA溶液![]() 与
与![]() 的NaOH溶液
的NaOH溶液![]() 混合而得,则下列说法正确的是______
混合而得,则下列说法正确的是______
A.若反应后溶液呈中性,则![]()
B.若![]() ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则![]() 一定大于
一定大于![]()
D.若反应后溶液呈碱性,则![]() 一定小于
一定小于![]()
(4)常温下,浓度均为![]() 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示:
溶质 |
|
|
| NaClO | NaCN |
pH |
|
|
|
|
|
①根据表中数据,将浓度均为![]() 的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
A.HCN![]()
![]()
![]()
②根据以上数据,判断下列反应可以成立的是______.
A.![]()
![]()
C.![]()
![]()
(5)几种离子开始沉淀时的pH如下表:
离子 |
|
|
|
pH |
|
|
|
当向含相同浓度![]() 、
、![]() 、
、![]() 离子的溶液中滴加NaOH溶液时,______
离子的溶液中滴加NaOH溶液时,______![]() 填离子符号
填离子符号![]() 先沉淀,
先沉淀,![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.