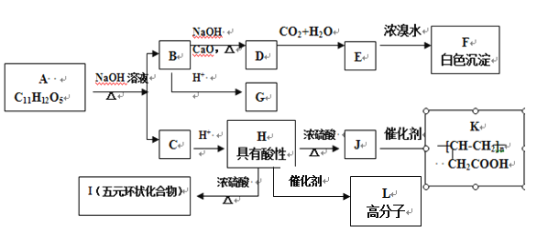
题目内容
【题目】二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(l) △H3
④H2O(l)=H2O(g) △H4=+44.0kJ/mol
(1)已知反应CO2(g)+H2(g)=CO(g)+H2O(g)△H,中相关的化学键键能数据如下:

由此计算△H=______,则△H3=_______。
(2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是___。
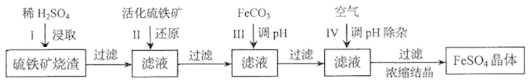
(3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示,图中A点和B点的平衡常数比较:KA___KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:a.___。b.___。
(4)常温常压下,向一个2.00L的密闭恒容容器中加入等量2.00mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)________、_________。

【答案】﹣80kJ/mol ﹣124kJ/mol 2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l) △H=﹣134.8kJ/mol = 温度越高,二甲醚的选择性越大 低温时硅铝比对二甲醚的选择性影响不大;高温时随着硅铝比增大,二甲醚的选择性先增大后减小 30.0% 3.06×105
【解析】
(1)反应物总键能减去生成物总键能等于该反应焓变,根据盖斯定律将已知的热化学方程式叠加,可得总反应方程式;
(2)根据盖斯定律将已知的热化学方程式叠加,△H进行相应的改变,可得总反应方程式;
(3)化学平衡常数只与温度有关,温度不变化学平衡常数不变;相同温度下,根据曲线变化趋势与硅铝比分析;不同温度下,硅铝比相同时,比较其选择性关系;
(4)根据物质反应转化关系,计算平衡时各种物质的浓度,带入平衡常数表达式和物质转化率含义式,可得相应的数值。
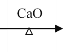
(1)CO2(g)+H2(g)=CO(g)+H2O(g) △H=(745×2+436-1076-2×465)kJ/mol=-80kJ/mol;
i .H2O(l)=H2O(g) △H4=+44.0kJ/mol
ii. CO2(g)+H2(g)=CO(g)+H2O(g) △H
将方程式ii-i得CO2(g)+H2(g)=CO(g)+H2O(l) △H3=△H-△H4=(-80-44.0)kJ/mol=-124kJ/mol;
(2)①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
将方程式2×①+②得2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l) △H=2(-55.7kJ/mol)+(-23.4)kJ/mol=-134.8kJ/mol;
(3)化学平衡常数只与温度有关,温度不变化学平衡常数不变,A、B两点温度相同,则KA=KB,根据图知有关变化规律,a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小;
(4)起始状态c(H2)=c(CO2)= 2.00mol÷2.00L=1.00mol/L;根据题意可知反应达到平衡时c(CH3OCH3)=0.150mol/L,则根据物质转化关系可知,c(CH3OCH3)=0.450mol/L,c(CO2)=1.00mol/L-2×0.150mol/L=0.700mol/L,c(H2)=1.00mol/L-6×0.150mol/L=0.100mol/L,所以CO2的转化率=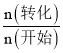 ×100%=
×100%=![]() ×100%=30.0%;化学平衡常数K=
×100%=30.0%;化学平衡常数K=![]() =3.06×105。
=3.06×105。

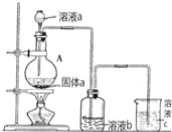
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
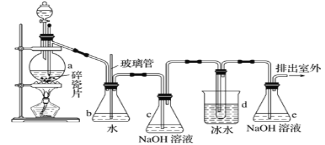
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)装置a中发生主要反应的方程式为:___。为防止副反应发生,实验中的具体操作为:___。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,如果实验时d装罝中导管堵塞,你认为可能的原因:___;安全瓶b还可以起到的作用是:___。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是___。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比理论值超过许多,如果装罝的气密性没有问题,试分析可能的原因:___、___(写出两条即可)。
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。