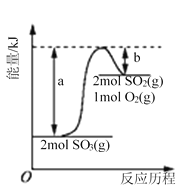
题目内容
【题目】工业废气中氮氧化物(NO、NO2等,以通式NOx表示)是主要的大气污染物之一。
利用甲烷可消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
组别 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
① | T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
② | T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 | 0.15 |
回答下列问题:
(1)组别①中,0~10min内NO2的平均降解速率为v(NO2)= ________________。
(2)由实验数据可知实验控制的温度T2_____T1(填“>”或“<”),请简述理由__________。
(3)组别②中,T2温度下40min时n(CH4)=________mol。该反应正反应为_______反应(填“吸热”或“放热”),理由是_____________________________。
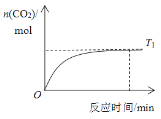
(4)温度T1时CO2物质的量随时间的变化如下图,在图中画出温度T2时CO2物质的量随时间的变化曲线________。
(5)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_________。
【答案】0.03mol/(Lmin) > 相同时间内,T2中参与反应的甲烷的物质的量较T1大 0.15 放热 温度越高CH4的转化率越低 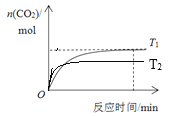 2xCO+2NOx
2xCO+2NOx![]() N2+2xCO2
N2+2xCO2
【解析】
(1)先计算①中,0~10min内V(CH4),然后根据速率比等于化学计量数的比计算V(NO2);
(2)在不同温度下,在相同时间内反应的CH4的多,化学反应速率快,结合温度对化学反应速率的影响分析判断;
(3)组别②中温度比①高,反应速率快,达到平衡所需要的时间短,①在40min时达到平衡,则组别②也达到了平衡,根据平衡温度分析;根据甲烷在T1、T2平衡含量分析温度对平衡移动的影响;
(4)升高温度,反应速率快,达到平衡所需要的时间短;且升高温度平衡逆向移动分析判断;
(5)CO与NOx反应,生成CO2、N2,根据原子守恒、电子守恒书写反应方程式。
(1)①中,0~10min内V(CH4)=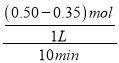 =0.015mol/(L·min),根据方程式CH4(g)+2NO2(g)
=0.015mol/(L·min),根据方程式CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)可知:V(NO2):V(CH4)=2:1,所以V(NO2)=2 V(CH4)= 0.03mol/(L·min);
N2(g)+CO2(g)+2H2O(g)可知:V(NO2):V(CH4)=2:1,所以V(NO2)=2 V(CH4)= 0.03mol/(L·min);
(2)根据表格数据可知:在相同时间内,T2中参与反应的甲烷的物质的量较T1大,说明反应速率T2>T1,由于在其它条件不变时,升高温度,化学反应速率加快,所以温度T2>T1;
(3)组别②中温度比①高,在40min时已经达到平衡,根据表格数据可知n(CH4)=0.15mol;
在温度为T1时CH4的平衡的物质的量为0.10mol;在温度为T2时CH4的平衡的物质的量为0.15mol.由于温度T2>T1,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应为吸热反应,所以该反应的正反应为放热反应;
(4)升高温度,反应速率快,达到平衡所需要的时间短。由于温度T2>T1,所以在温度为T2时先达到平衡。由于CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)的正反应是放热反应,所以升高温度,平衡逆向移动,平衡时CO2的物质的量比温度为T1时少所以温度与CO2的物质的量关系图像为:
N2(g)+CO2(g)+2H2O(g)的正反应是放热反应,所以升高温度,平衡逆向移动,平衡时CO2的物质的量比温度为T1时少所以温度与CO2的物质的量关系图像为: ;
;
(5)CO与NOx反应,生成CO2、N2,根据原子守恒、电子守恒可得:该反应的化学方程式为2xCO+2NOx![]() N2+2xCO2。
N2+2xCO2。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案