题目内容
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
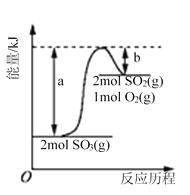
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
【答案】A
【解析】
A. 断键需要吸热,形成化学键需要放热,则该化学反应过程中既有能量的吸收又有能量的释放,A正确;
B. 反应热等于断键吸收的总能量和形成化学键所放出的总能量的差值,则根据图像可知反应2SO3(g)![]() 2SO2(g)+O2(g)的△H=(a-b) kJ/mol,B错误;
2SO2(g)+O2(g)的△H=(a-b) kJ/mol,B错误;
C. 根据图像可知0.5mol氧气和1 mol SO2的总能量比1 mol SO3的能量高,二氧化硫和三氧化硫的能量不能比较,C错误;
D. 由于是可逆反应,转化率达不到100%,因此若某容器内有2 mol SO3充分反应,吸收的热量小于(a-b) kJ,D错误。
答案选A。

【题目】工业废气中氮氧化物(NO、NO2等,以通式NOx表示)是主要的大气污染物之一。
利用甲烷可消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
组别 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
① | T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
② | T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 | 0.15 |
回答下列问题:
(1)组别①中,0~10min内NO2的平均降解速率为v(NO2)= ________________。
(2)由实验数据可知实验控制的温度T2_____T1(填“>”或“<”),请简述理由__________。
(3)组别②中,T2温度下40min时n(CH4)=________mol。该反应正反应为_______反应(填“吸热”或“放热”),理由是_____________________________。
(4)温度T1时CO2物质的量随时间的变化如下图,在图中画出温度T2时CO2物质的量随时间的变化曲线________。

(5)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_________。
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.010mol·L-1氨水 | 用量筒量取10.0mL5.00mol·L-1氨水于烧杯中,加入少量蒸馏水稀释,转移至500 mL容量瓶中定容 |
B | 探究SO2的还原性 | 向盛有2mLH2S溶液的试管中缓慢通入SO2,观察是否有沉淀生成 |
C | 制取并纯化溴苯 | 向FeBr3固体中慢慢加入Br2的苯溶液,充分反应后经水洗、Na2SO3溶液洗、水洗、分液、干燥,然后蒸馏 |
D | 比较两种黑色固体FeS和CuS的溶度积 | 向物质的量浓度相同的FeCl2和CuCl2的混合溶液中不断加入Na2S溶液,观察沉淀颜色 |
A. A B. B C. C D. D