题目内容
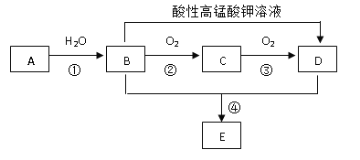
【题目】已知烃A 的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)写出A的结构简式_________; A 、B 中官能团的名称和化学式__________;
(2)B→C的化学方程式为____________________,①,②反应类型为__________;
(3)B的结构式为____________________。若B中含有少量H2O,可加入_____________蒸馏除去。
(4)D与少量Na2CO3反应的离子方程式____________________。
(5)已知乙醇能发生如下脱水反应:CH3CH2OH+HOCH2CH3![]() CH3CH2OCH2CH3+ H2O,乙酸也能发生类似的脱水反应生成乙酸酐,写出该反应的化学方程式____________________。
CH3CH2OCH2CH3+ H2O,乙酸也能发生类似的脱水反应生成乙酸酐,写出该反应的化学方程式____________________。
【答案】CH2=CH2 碳碳双键![]() 、羟基 –OH 2 CH3CH2OH+O2
、羟基 –OH 2 CH3CH2OH+O2![]() 2 CH3CHO + 2H2O 加成反应,氧化反应
2 CH3CHO + 2H2O 加成反应,氧化反应 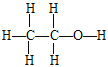 生石灰(或CaO) 2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ CH3COOH + CH3COOH →
生石灰(或CaO) 2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ CH3COOH + CH3COOH →![]() + H2O
+ H2O
【解析】
烃A的产量通常用来衡量一个国家石油化工水平,则A是乙烯,乙烯和水发生加成反应生成的B是乙醇,乙醇和氧气反应生成C,则C是乙醛,C进一步发生氧化反应生成的D为乙酸,乙醇与乙酸反应生成的E为乙酸乙酯。
(1)由上述分析可知A为乙烯,A的结构简式CH2=CH2,A中含有的官能团为碳碳双键![]() ,B为乙醇,B中官能团为羟基 –OH,因此本题正确答案是: CH2=CH2;碳碳双键
,B为乙醇,B中官能团为羟基 –OH,因此本题正确答案是: CH2=CH2;碳碳双键![]() 、羟基 -OH 。
、羟基 -OH 。
(2) B→C是乙醇发生氧化反应生成乙醛,反应方程式为: 2 CH3CH2OH+O2![]() 2 CH3CHO + 2H2O ;反应①是乙烯与水发生加成反应生成乙醇,反应②是乙醇发生氧化反应生成乙醛;答案:CH3CH2OH+O2
2 CH3CHO + 2H2O ;反应①是乙烯与水发生加成反应生成乙醇,反应②是乙醇发生氧化反应生成乙醛;答案:CH3CH2OH+O2![]() 2 CH3CHO + 2H2O ;加成反应;氧化反应。
2 CH3CHO + 2H2O ;加成反应;氧化反应。
(3)B为乙醇,B的结构式为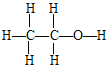 。若B中含有少量H2O,可加入生石灰CaO与水反应,CaO与乙醇不反应,进而蒸馏除去水。答案:
。若B中含有少量H2O,可加入生石灰CaO与水反应,CaO与乙醇不反应,进而蒸馏除去水。答案: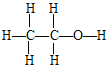 ;生石灰(或CaO)
;生石灰(或CaO)
(4)D为乙酸与少量Na2CO3反应的离子方程式:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑;答案:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑。
(5)已知乙醇能发生如下脱水反应:CH3CH2OH+HOCH2CH3![]() CH3CH2OCH2CH3+ H2O,乙酸也能发生类似的脱水反应生成乙酸酐,反应的化学方程式为:CH3COOH + CH3COOH →
CH3CH2OCH2CH3+ H2O,乙酸也能发生类似的脱水反应生成乙酸酐,反应的化学方程式为:CH3COOH + CH3COOH →![]() + H2O。
+ H2O。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】工业废气中氮氧化物(NO、NO2等,以通式NOx表示)是主要的大气污染物之一。
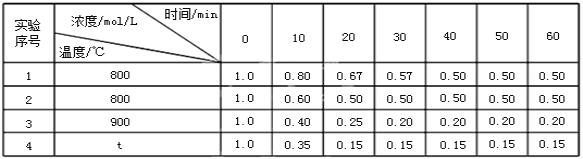
利用甲烷可消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
组别 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
① | T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
② | T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 | 0.15 |
回答下列问题:
(1)组别①中,0~10min内NO2的平均降解速率为v(NO2)= ________________。
(2)由实验数据可知实验控制的温度T2_____T1(填“>”或“<”),请简述理由__________。
(3)组别②中,T2温度下40min时n(CH4)=________mol。该反应正反应为_______反应(填“吸热”或“放热”),理由是_____________________________。
(4)温度T1时CO2物质的量随时间的变化如下图,在图中画出温度T2时CO2物质的量随时间的变化曲线________。

(5)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_________。