题目内容
【题目】研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
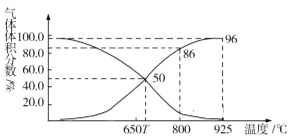
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1 增大CH4的浓度 增大 2NH3-6e-+6OH-=N2+6H2O 正向 不 25% 5.28p总
【解析】
(1) ①ⅠCH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
ⅡCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
根据盖斯定律,由![]() (Ⅰ+Ⅱ)得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=
(Ⅰ+Ⅱ)得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=![]() (△H1+△H2)=
(△H1+△H2)=![]() (-574 kJ·mol-1-1160 kJ·mol-1)=-867 kJ·mol-1;
(-574 kJ·mol-1-1160 kJ·mol-1)=-867 kJ·mol-1;
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,增大CH4的浓度,反应速率增大,反应正向移动,NO2的转化率增大;
③正极反应式为2NO2+8e-+4H2O=N2+8OH-,产生OH-,c(OH-)增大,pH增大,NO2在正极上反应,NO2得到电子;负极区失去电子,化合价升高,因此NH3在负极反应,反应式为2NH3-6e-+6OH-=N2+6H2O;
(2)①该反应正向为气体分子数增大的反应,恒温恒压时充入稀有气体,对该反应来说相当于减压,v(正)>v(逆),平衡正向移动;T ℃时,反应达到平衡时CO2、CO的体积分数相同,即浓度相等,恒压条件下充入等体积的CO2和CO,各物质的浓度都不变,故平衡不移动;
②设CO2的转化率为a,由已知列三段式得:
化学反应方程式: C(s)+ CO2(g) ![]() 2CO(g)
2CO(g)
起始物质的量/mol 1 0
转化物质的量mol a 2a
平衡物质的量/mol 1-a 2a
根据题意列关系式: ![]() ×100%=40%,解得: a=25%;
×100%=40%,解得: a=25%;
③用平衡浓度表示该反应化学平衡常数表达式为K=![]() ,所以若用平衡分压代替平衡浓度表示平衡常数的表达式为Kp=
,所以若用平衡分压代替平衡浓度表示平衡常数的表达式为Kp=![]() ,由图可得,800℃时CO体积分数为86%,分压为86%×p总, CO2体积分数为14%,分压为14%×p总,所以Kp=
,由图可得,800℃时CO体积分数为86%,分压为86%×p总, CO2体积分数为14%,分压为14%×p总,所以Kp=![]() =
=![]() =5.28p总。
=5.28p总。

 名校课堂系列答案
名校课堂系列答案【题目】(1)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍。回答下列有关问题:
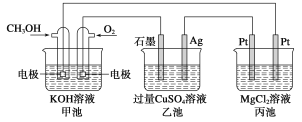
如图所示:
①甲池通入CH3OH的电极反应式为__________;乙池石墨一极的电极反应式为______;
②反应一段时间后,向乙池中加入一定量________能使CuSO4溶液恢复到原浓度;
③甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生__________g沉淀。
(2)工业上有一种生产甲醇的反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
容器 | A | B |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
CH3OH(g)浓度(molL-1) | c1 | c2 |
反应能量变化 | 放出29.4kJ | 吸收akJ |
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为______________;
②该温度下,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
③a=______________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是____________。
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
【题目】工业废气中氮氧化物(NO、NO2等,以通式NOx表示)是主要的大气污染物之一。
利用甲烷可消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
组别 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
① | T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
② | T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 | 0.15 |
回答下列问题:
(1)组别①中,0~10min内NO2的平均降解速率为v(NO2)= ________________。
(2)由实验数据可知实验控制的温度T2_____T1(填“>”或“<”),请简述理由__________。
(3)组别②中,T2温度下40min时n(CH4)=________mol。该反应正反应为_______反应(填“吸热”或“放热”),理由是_____________________________。
(4)温度T1时CO2物质的量随时间的变化如下图,在图中画出温度T2时CO2物质的量随时间的变化曲线________。

(5)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_________。