题目内容
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。其中反应④的离子方程式为 4 NH4++5O2=2 NO2-+6H++N2O+5H2O,下列说法正确的是
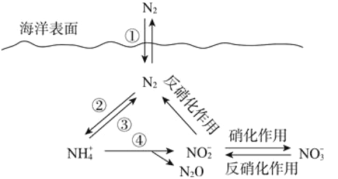
A. ①②均属于固氮反应
B. 海洋中的反硝化作用一定有氧气参加
C. 反应④中每生成 1molH2O 共转移 2mol e-
D. 向海洋排放含NO3- 的废水可能影响海洋中氮的循环
【答案】D
【解析】
A.氮的固定是游离态的氮变为化合态的氮,①不属于氮的固定,②是氮的固定,故A错误;
B.反硝化作用:反硝化细菌在缺氧条件下,还原硝酸盐,释放出分子态氮(N2)或一氧化二氮(N2O)的过程,不一定有氧参加,故B错误;
C.根据4NH4++5O2=2NO2-+6H++N2O+5H2O,氮元素化合价-3价变化为+1价和+3价,氧元素化合价0价变化为-2价,电子转移总数20e-,生成 1molH2O 共转移4mol e-,故C错误;
D.向海洋排放含NO3-的废水,硝酸根离子浓度增大,反硝化作用增强,破坏原有的化学平衡和生态平衡,可能会影响海洋中氮的循环,故D正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目