题目内容
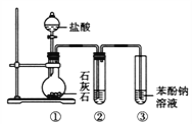
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
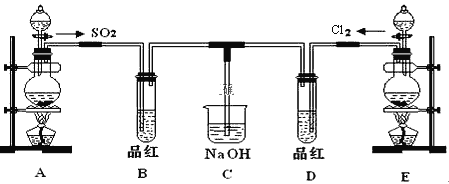
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_______________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为_______________________。除去Cl2中混有的HCl,可将气体通过盛有_______________________的洗气瓶。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:_________________________,D:________________________。
(4)停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________________________,D:__________________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)______________。
【答案】分液漏斗的玻璃塞没有取下来 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 饱和氯化钠的水溶液 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O===2HCl+H2SO4
MnCl2+Cl2↑+2H2O 饱和氯化钠的水溶液 品红褪色 品红褪色 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O===2HCl+H2SO4
【解析】
装置A生成的二氧化硫气体通过装置B中的品红溶液,二氧化硫具有漂白性,可以使溶液褪色,褪色后的溶液加热时又恢复原来的红色。氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色,次氯酸的漂白不可逆,加热时,不能恢复红色,剩余二氧化硫和氯气通过装置C吸收,防止污染空气,以此解答该题。
(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,
故答案为:分液漏斗的玻璃塞没有取下来;
(2)实验室用二氧化锰和浓盐酸混合加热制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;除去Cl2中混有的HCl,可将气体通过盛有饱和氯化钠的水溶液
MnCl2+Cl2↑+2H2O;除去Cl2中混有的HCl,可将气体通过盛有饱和氯化钠的水溶液
的洗气瓶。
故答案为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;饱和氯化钠的水溶液;
MnCl2+Cl2↑+2H2O;饱和氯化钠的水溶液;
(3)SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色;
故答案为:品红褪色;品红褪色;
(4)SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色;次氯酸的漂白不可逆,加热时,不能恢复红色,
故答案为:褪色的品红又恢复成红色;无明显现象;
(5)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O===2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不退色,
故答案为:Cl2+SO2+2H2O===2HCl+H2SO4。

【题目】已知下列数据:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙 醇 | -114 | 78.4 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓H2SO4 | 338 | 1.84 |



实验室制取乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛有10mL饱和Na2CO3溶液的(加入2滴酚酞试液)试管中;③小火加热试管中的混合液;④待小试管中收集约2mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_____________________________;
(2)写出该实验制取乙酸乙酯的化学方程式_________________________________,浓H2SO4的作用是 _______________________;
(3)步骤③中,用小火加热试管中的混合液,其原因_________________________;
(4)步骤④所观察到的现象是___________________________________________________
(5)步骤⑤中,分离出乙酸乙酯的方法是_________________________________;
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取圆底烧瓶中产物)。你认为哪种装置更合理,为什么?_____。