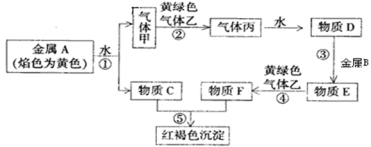
��Ŀ����
����Ŀ��A��B��C��DΪԭ�������������������Ԫ�أ�A2-��B+������ͬ�ĵ��ӹ��ͣ�C�� DΪͬ����Ԫ�أ�C�������������������������3����DԪ���������һ��δ�ɶԵ��ӡ��ش��������⣺
(1)����Ԫ���е縺��������______(��Ԫ�ط���)������Cԭ�ӵĺ�������Ų�ʽΪ__________��
(2)A��D����Ԫ���γɵ�����⻯���У����зе�ϸߵ���_____(�����ʽ)��ԭ����________________��A��B���⻯�������ľ������ͷֱ�Ϊ______��______��
(3)C��D��Ӧ��������ɱ�Ϊ1��3�Ļ�����E�� E�����幹��Ϊ______������ԭ�ӵ��ӻ��������Ϊ______��
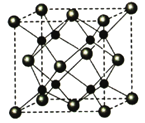
(4)A��B�ܹ��γɻ�����F���侧���ṹ��ͼ��ʾ�������߳�a��5.66x10-8cm�� F �Ļ�ѧʽΪ______��������A ԭ�ӵ���λ��Ϊ_________����ʽ���㾧��F���ܶ�(g��cm-3)_______________________________��(����ʽ����)
���𰸡�O 1s22s22p63s23p3 H2O ˮ����֮�����γ���� ���Ӿ��� ���Ӿ��� ������ sp3 Na2O 8 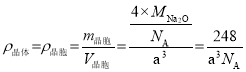
��������
��A2-��B+������ͬ�ĵ��Ӳ�ṹ��֪��A��Bλ���������ڣ�����AΪ��AԪ�� ��BΪ��AԪ�أ���C�ĺ����������Ϊ������������3����֪�������������Ӹ���Ϊ5ʱ����������CΪPԪ�أ���ôA��B�ֱ�ΪO��NaԪ�أ�����D��Cͬ���ڣ���DԪ�������ֻ��һ��δ�ɶԵ��ӣ���ôDΪClԪ�ء�
(1)���ڱ������ң�Ԫ�صĵ縺��������ڱ����ϵ��£�Ԫ�صĵ縺����С���������Ԫ���е縺��������O��ͨ��������֪��CΪPԪ�أ����̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p3��
(2)ͨ��������֪��AΪOԪ�أ�DΪClԪ�أ�BΪNaԪ�أ�O��Cl�γɵļ��⻯��ֱ�ΪH2O��HCl������H2O�ķе�ϸߣ���ΪH2O���Ӽ�����γ������A�γɵ��⻯��ΪH2O�����ڷ��Ӿ��壻B�γɵ��⻯��ΪNaH���������Ӿ��壻
(3)ͨ��������֪��EΪPCl3������3���ɼ����Ӷ��Լ�һ���µ��Ӷԣ����ӹ���Ϊ�����Σ�Pԭ�Ӳ���sp3�ӻ���ʽ�γɵ��ӻ������
(4)ͨ��������֪��AΪOԪ�أ�BΪNaԪ�أ��ɾ����ṹ��֪�������ھ����������Լ����㴦��С���ھ������ڲ������һ�������д����С��ĸ�����Ϊ1:2������O2-�뾶����Na+�����Ը����ʼ�ΪNa2O��A��Ӧ�����Ӽ�O2-���Ǿ����нϴ������λ��Ϊ8���þ�����ܶ�Ϊ��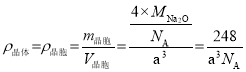 ��
��

����Ŀ����Դ������������������Դ���õ��ǵ����������Ż��⡣�������ѧ��ѧ֪ʶ�ش��������⣺
(1)�����ϰ�װ��ת��������ʹ����β���е���Ҫ��Ⱦ��(CO��NOx��̼�⻯����)�������Ӧ�����������ʣ���������β����Ⱦ��
��֪��N2(g) + O2(g)��2NO(g) ��H��+180.5 kJ��mol��1��
2C(s)+ O2(g)��2CO(g) ��H����221.0 kJ��mol��1��
C(s)+ O2(g)��CO2(g) ��H����393.5 kJ��mol��1��
��β��ת����Ӧ2NO(g) +2CO(g)��N2(g)+2CO2(g)�ġ�H��________________��
(2)ij���᳧���ü״�������ˮ����һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32 g CH3OHת��6 mol���ӣ���μӷ�Ӧ�Ļ�ԭ���������������ʵ���֮��Ϊ______________��
(3)ú�ļ��Һ������ת��ΪCO��H2�����ڴ��������ºϳɼ״�������һ���¶��£���1 L�ܱ������м���CO��H2��������ӦCO(g)+2H2(g)CH3OH(g)����10 min��Ӧ�ﵽƽ��ʱ��ø���ֵ�Ũ�����£�
���� | CO | H2 | CH3OH |
Ũ��/(mol��L��1) | 1.2 | 1.0 | 0.6 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ��K��_____________________��
�ڸ�ʱ���ڷ�Ӧ������(H2)��_________________��
��ƽ��ʱCO��ת����Ϊ_________________(����1λС��)