题目内容
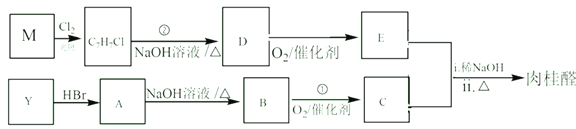
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
![]()
(1)若A是一种金属,C是淡黄色固体,写出C的一种用途____;
(2)若常温下A为淡黄色固体单质,D为强酸,则B为___,D的浓溶液能使胆矾晶体由蓝变白,体现了D的___性。
(3)若A是化合物,C是红棕色气体,则
①A的电子式为___,实验室制备A气体的化学方程式为___。
②实验室检验A气体的方法为___。
③C转化为D的过程中,氧化剂与还原剂的质量比为___。
④将盛满B气体的试管倒扣在水槽中,并通入一定量O2,最终气体全部被吸收,所得溶液充满整个试管。若不考虑溶液扩散,计算所得溶液物质的量浓度为___mol·L-1。(标况下计算,保留两位有效数字)
【答案】供氧剂(或杀菌剂、消毒剂、漂白剂等) SO2 吸水 ![]() 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 用湿润的红色石蕊试纸靠近试管口,试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生) 1:2 0.045
CaCl2+2NH3↑+2H2O 用湿润的红色石蕊试纸靠近试管口,试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生) 1:2 0.045
【解析】
(1)C是淡黄色固体,为金属氧化物,则其为Na2O2,由此可确定它的用途;
(2)若常温下A为淡黄色固体单质,则其为硫,由转化关系可确定其它物质及性质。
(3)C是红棕色气体,则C为NO2气体,由转化关系可确定其它物质及性质。
(1)由C是淡黄色固体,可确定其为Na2O2,其用途为供氧剂(或杀菌剂、消毒剂、漂白剂等)。答案为:供氧剂(或杀菌剂、消毒剂、漂白剂等);
(2)若常温下A为淡黄色固体单质,则其为硫(S),D为强酸(H2SO4),则B为SO2,C为SO3,D的浓溶液能使胆矾晶体由蓝变白,体现了浓硫酸的吸水性。答案为:SO2;吸水;
(3)若A是化合物,C是红棕色气体,则C为NO2。
①A氧化后,产物再氧化可生成NO2,则A为NH3,电子式为![]() ,实验室制备氨气时,药品为NH4Cl和Ca(OH)2,化学方程式为2NH4Cl+Ca(OH)2
,实验室制备氨气时,药品为NH4Cl和Ca(OH)2,化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。答案为:
CaCl2+2NH3↑+2H2O。答案为:![]() ;2NH4Cl+Ca(OH)2
;2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②实验室检验氨气时,采用的方法为用湿润的红色石蕊试纸靠近试管口,试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生)。答案为:用湿润的红色石蕊试纸靠近试管口,试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生);
③C转化为D的过程中,发生反应为3NO2+H2O=2HNO3+NO,从价态变化看,若3molNO2参加反应,有1molNO2中的N元素价态降低,有2molNO2中的N元素价态升高,则氧化剂与还原剂的质量比为1:2。答案为:1:2;
④假设试管的体积为VL,则c=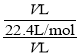 =0.045 mol·L-1。答案为:0.045。
=0.045 mol·L-1。答案为:0.045。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案