题目内容
(10分)已知A、B、C是第2周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子。请填空:
(1)写出A、B、C、D对应的元素符号:A.______、B. _____、C.______、D.______。
(2)写出工业生产中BD3与氧气反应的化学方程式:__________________________。
 (3)你认为B、C、D元素形成的化合物之间_________(填“能”或“不能”)发生下面的反应BC+BD3 D BC2+D2C,得出上面结论的理由是________________。
(3)你认为B、C、D元素形成的化合物之间_________(填“能”或“不能”)发生下面的反应BC+BD3 D BC2+D2C,得出上面结论的理由是________________。
 (4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:
4AC(g)+2BC2(g) 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是__________(用含a的代数式表示)。
Ⅱ.若维持温度不变,在一个与Ⅰ反应前的起始体积相同容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a_________b(填“>”“<”“=”或“不能确定”=。
(1)写出A、B、C、D对应的元素符号:A.______、B. _____、C.______、D.______。
(2)写出工业生产中BD3与氧气反应的化学方程式:__________________________。
 (3)你认为B、C、D元素形成的化合物之间_________(填“能”或“不能”)发生下面的反应BC+BD3 D BC2+D2C,得出上面结论的理由是________________。
(3)你认为B、C、D元素形成的化合物之间_________(填“能”或“不能”)发生下面的反应BC+BD3 D BC2+D2C,得出上面结论的理由是________________。 (4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g) 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是__________(用含a的代数式表示)。
Ⅱ.若维持温度不变,在一个与Ⅰ反应前的起始体积相同容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a_________b(填“>”“<”“=”或“不能确定”=。
(1)C N O H
(2)4NH3+5O2 4NO+5H2O
4NO+5H2O
(3)不能 在此反应关系中,只有失电子的物质,没有得电子的物质
(4)Ⅰ.80a% Ⅱ.>
(2)4NH3+5O2
 4NO+5H2O
4NO+5H2O(3)不能 在此反应关系中,只有失电子的物质,没有得电子的物质
(4)Ⅰ.80a% Ⅱ.>
本题是元素化合物及平衡的综合题,涉及的知识面较宽,考查学生的综合运用能力。思路如下:A、B、C是第2周期的非金属元素,其原子序数依次增大是一个突破口,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子是另一个突破口,即等电子体,再加上所告诉的分子式,所以可知A.C;B.N;C.O;D.H。
(2)NH3的催化氧化原理:4NH3+5O2 4NO+5H2O
4NO+5H2O
(3)氧化还原反应遵守得失电子守恒的原理:有得有失。本方程式只有失电子的物质,没有得电子的物质,所以不能发生。
(4)该反应是4CO+2NO2====4CO2+N2,由题意可知CO2为4a/5 mol, N2为a/5 mol,所以转化的CO为4a/5 mol,,转化率为80a%。向容器中充入AC和BC2各1 mol,容积体积相同且固定,即恒温恒容,反应向正方向进行,所以压强减小,导致恒温恒压下的压强大于恒温恒容时的压强,所以恒温恒压下反应向正方向进行程度大,所以a>b。
(2)NH3的催化氧化原理:4NH3+5O2
 4NO+5H2O
4NO+5H2O(3)氧化还原反应遵守得失电子守恒的原理:有得有失。本方程式只有失电子的物质,没有得电子的物质,所以不能发生。
(4)该反应是4CO+2NO2====4CO2+N2,由题意可知CO2为4a/5 mol, N2为a/5 mol,所以转化的CO为4a/5 mol,,转化率为80a%。向容器中充入AC和BC2各1 mol,容积体积相同且固定,即恒温恒容,反应向正方向进行,所以压强减小,导致恒温恒压下的压强大于恒温恒容时的压强,所以恒温恒压下反应向正方向进行程度大,所以a>b。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
 2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是
2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是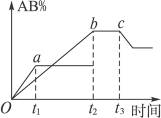
 pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是 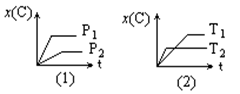
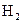 的总量,可采取的措施是( )
的总量,可采取的措施是( )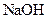 固体
固体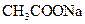 固体
固体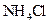 固体
固体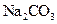 固体
固体 H2(g)+I2(g)已达到平衡状态的是( )
H2(g)+I2(g)已达到平衡状态的是( )