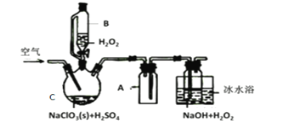
题目内容
【题目】铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:
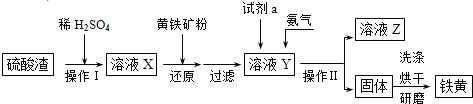
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是___、___。
(2)试剂a最好选用___(供选择使用的有:铝粉、空气、浓HNO3);其作用是___。
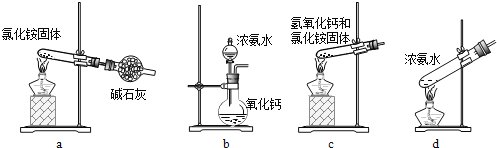
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是___(填序号)。
(4)检验溶液Z中含有NH4+的方法是___。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如图所示。
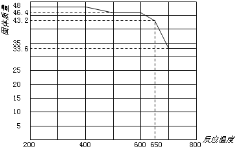
根据图象推断650℃时Fe2O3还原产物的化学式为___,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。___。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
【答案】搅拌加速溶解(或搅拌加速反应) 引流 空气 作氧化剂,将Fe2+氧化为Fe3+ bd 取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+ FeO 取少量还原产物置于试管中,加入过量稀硫酸(或稀盐酸),固体完全溶解且无气泡产生;再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,证明还原产物为FeO
【解析】
(1)操作Ⅰ是利用玻璃棒搅拌加速硫酸渣的溶解,操作Ⅱ是过滤实验,玻璃棒起到引流作用;
(2)依据流程分析,试剂a是用来氧化亚铁离子的,选择试剂时不能引入新的杂质;
(3)a、加热氯化铵分解后生成的氨气和氯化氢会在试管口重新生成氯化铵,不能制得氨气;
b、氨水滴入氧化钙固体,氧化钙会和水反应生成氢氧化钙放热,使一水合氨分解生成氨气;
c、氢氧化钙和氯化铵固体加热时需要试管口略向下倾斜,图中装置加热时会使生成的水倒流到试管底部炸裂试管;
d、加热浓氨水会分解生成氨气,可以制取氨气;
(4)检验溶液Z中含NH4+,可利用铵根离子和氢氧根离子加热反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝;
(5)根据数据进行计算,结合产物进行判断。
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,操作Ⅰ是利用玻璃棒搅拌加速硫酸渣的溶解,操作Ⅱ是过滤实验,玻璃棒起到引流作用;
(2)依据流程分析,试剂a是用来氧化亚铁离子的,选择试剂时不能引入新的杂质,铝粉不能将Fe2+氧化,浓硝酸做氧化剂会产生污染气体,最好选择空气做氧化剂氧化亚铁离子,不会引入新的杂质,不污染环境;
(3)a、加热氯化铵分解后生成的氨气和氯化氢会在试管口重新生成氯化铵,不能制得氨气;
b、氨水滴入氧化钙固体,氧化钙会和水反应生成氢氧化钙放热,使一水合氨分解生成氨气;
c、氢氧化钙和氯化铵固体加热时需要试管口略向下倾斜,图中装置加热时会使生成的水倒流到试管底部炸裂试管;
d、加热浓氨水会分解生成氨气,可以制取氨气;
答案为bd;
(4)检验溶液Z中含NH4+,可利用铵根离子和氢氧根离子加热反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝;方法是取少量溶液Z置于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝色,证明含有NH4+;
(5)根据图示n(Fe2O3)=![]() =0.3mol;650℃时固体的质量为43.2g,根据Fe守恒,43.2g固体中n(Fe)=0.6mol,n(O)=
=0.3mol;650℃时固体的质量为43.2g,根据Fe守恒,43.2g固体中n(Fe)=0.6mol,n(O)=![]() =0.6mol,n(Fe):n(O)=1:1,则还原产物为FeO;为验证还原产物,在适量待检物中加入过量稀H2SO4(或稀盐酸)至完全溶解,再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,可说明还原产物为FeO。
=0.6mol,n(Fe):n(O)=1:1,则还原产物为FeO;为验证还原产物,在适量待检物中加入过量稀H2SO4(或稀盐酸)至完全溶解,再向其中滴加KSCN溶液,溶液不变色;最后滴加H2O2溶液,溶液变红色,可说明还原产物为FeO。