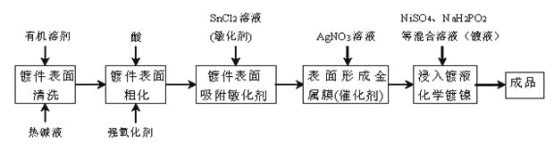
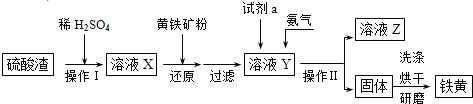
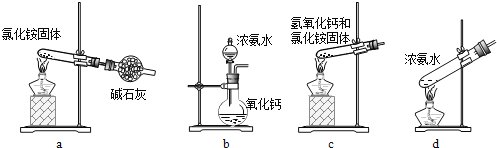
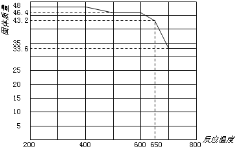
题目内容
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响。结果如表所示(
废水处理的影响。结果如表所示(![]() 的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )
的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是 ( )

A.实验ⅱ与实验ⅰ对比,其他条件不变,增加c(H+)有利于![]() 的去除
的去除
B.实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于![]() 的去除
的去除
C.实验ⅲ中Fe3+循环利用提高了![]() 的去除率
的去除率
D.若实验iV中去除0.0l mol ![]() ,电路中共转移0.06 mol电子
,电路中共转移0.06 mol电子
【答案】D
【解析】
A.对比实验i、ii,其它外界因素都相同,且溶液的酸性越强,![]() 的去除率越大,所以增加
的去除率越大,所以增加![]() 有利于
有利于![]() 的去除,故A正确;
的去除,故A正确;
B. 实验ⅲ与实验ⅱ对比,![]() 增大,
增大,![]() 的去除率也增大即其他条件不变,增加
的去除率也增大即其他条件不变,增加![]() 有利于
有利于![]() 的去除,故B正确;
的去除,故B正确;
C. 实验ⅲ中,![]() 在阴极上得电子,且溶液中的亚铁离子也能还原
在阴极上得电子,且溶液中的亚铁离子也能还原![]() ,离子方程式为
,离子方程式为![]() ,所以
,所以![]() 循环利用使
循环利用使![]() 去除率提高,故C正确;
去除率提高,故C正确;
D. 实验iv中,![]() 在阴极上得电子,阳极产生亚铁离子也能还原
在阴极上得电子,阳极产生亚铁离子也能还原![]() ,1个
,1个![]() 在阴极上被还原转移6个电子,阳极产生3个
在阴极上被还原转移6个电子,阳极产生3个![]() ,溶液中还有0.5个
,溶液中还有0.5个![]() 被
被![]() 还原,即转移6个电子时有1.5个
还原,即转移6个电子时有1.5个![]() 被还原,所以去除0.0l mol
被还原,所以去除0.0l mol![]() 时转移0.04mol电子, D错误;
时转移0.04mol电子, D错误;
答案选D。

【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液56滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。