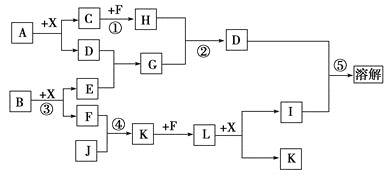
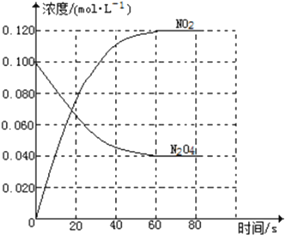
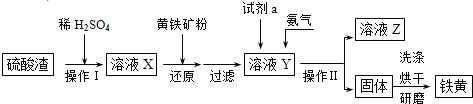
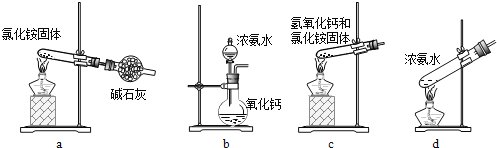
题目内容
【题目】有八种物质:①甲烷、②苯、③聚丙烯、④聚异戊二烯、⑤2一丁炔、⑥环己烷 ⑦邻二甲苯⑧裂解气,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑦⑧B.④⑤⑧C.④⑤⑦⑧D.③④⑤⑧
【答案】B
【解析】
①甲烷结构稳定,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选①;
②苯不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选②;
③聚丙烯![]() 不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选③;
不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选③;
④聚异戊二烯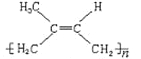 ,含有碳碳双键,能使酸性KMnO4溶液褪色也能与溴水反应,故选④;
,含有碳碳双键,能使酸性KMnO4溶液褪色也能与溴水反应,故选④;
⑤2一丁炔![]() 含有碳碳叁键,能使酸性KMnO4溶液褪色也能与溴水反应,故选⑤;
含有碳碳叁键,能使酸性KMnO4溶液褪色也能与溴水反应,故选⑤;
⑥环己烷,不含碳碳双键,不能使酸性KMnO4溶液褪色也不能与溴水反应,故不选⑥;
⑦邻二甲苯能被高锰酸钾氧化为对苯二甲酸,能使酸性KMnO4溶液褪色,不能与溴水反应,故不选⑦;
⑧裂解气,含有乙烯、丙烯等,能使酸性KMnO4溶液褪色也能与溴水反应,故选⑧;
选B。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液56滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1molL1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。