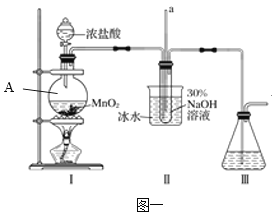
题目内容
【题目】液态化合物AB会发生微弱的自身电离,电离方程式为AB![]() A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
A.c(A+)随温度升高而降低B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25℃)>(35℃)D.AB的电离是吸热过程
【答案】D
【解析】
弱电解质存在电离平衡,升高温度,弱电解质的电离平衡常数增大,说明促进弱电解质电离,则弱电解质的电离是吸热过程,据此分析解答。
A.升高温度,其电离平衡常数增大,说明其电离程度增大,所以c(A+)随着温度升高而升高,A错误;
B.根据电离方程式AB![]() A++B-可知,在电解质AB溶液中,c(A+)=c(B-),B错误;
A++B-可知,在电解质AB溶液中,c(A+)=c(B-),B错误;
C.升高温度,其电离平衡常数增大,说明弱电解质AB的电离程度增大,所以AB的电离程度(25℃)<(35℃),C错误;
D.升高温度,平衡向吸热反应方向移动,AB的电离程度增大,则AB的电离是吸热过程,D正确;
故合理选项是D。

【题目】芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
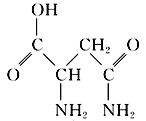
(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
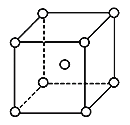
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。