题目内容
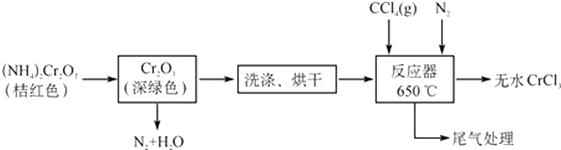
【题目】用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下
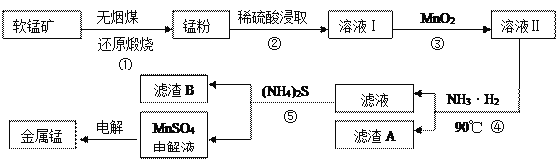
(1)已知锰粉的主要成分为MnO,反应①的化学方程式为________________________。
(2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:_______。
(3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为___________________________________________________________________。
(4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-25,要使滤渣A沉淀完全,需用氨水调pH至少为______(已知lg 3≈0.5)。
(5)溶液Ⅰ的主要成分为 ____________。滤渣B的主要成分为_________________。
(6)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为____________________。
【答案】 2MnO2+C![]() 2MnO+CO2↑(或MnO2+C
2MnO+CO2↑(或MnO2+C![]() MnO+CO↑) MnO2>Cl2>Fe3+ 2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O 6 MnSO4 CuS、HgS MnO42-- e-=== MnO4-
MnO+CO↑) MnO2>Cl2>Fe3+ 2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O 6 MnSO4 CuS、HgS MnO42-- e-=== MnO4-
【解析】试题分析:(1)碳具有还原性将MnO2还原为MnO;(2)氧化剂的氧化性大于氧化产物,结合实验室制备氯气和氯气氧化Fe2+分析;(3)MnO2的氧化性大于Fe3+,溶液I中加入一定质量的MnO2测定Fe2+的浓度, MnO2把Fe2+氧化为Fe3+;(4)根据Fe(OH)3的Ksp=6.4×10-25计算Fe3+完全沉淀时c(OH-),再根据水的离子积醋酸计算c(H+);(5)反应②是MnO与硫酸生成MnSO4和水;反应⑤加入(NH4)2S是除去溶液中的重金属离子Cu2+、Hg2+;(6)阳极发生氧化反应,锰酸钾生成高锰酸钾发生氧化反应,所以阳极反应是锰酸钾生成高锰酸钾。
解析:(1)碳具有还原性将MnO2还原为MnO,反应方程式是2MnO2+C![]() 2MnO+CO2↑;(2)氧化剂的氧化性大于氧化产物,实验室可用软锰矿与浓盐酸反应制Cl2说明氧化性MnO2>Cl2;氯气能把Fe2+氧化为Fe3+说明氧化性Cl2>Fe3+,所以氧化性MnO2>Cl2>Fe3+;(3)MnO2的氧化性大于Fe3+,溶液I中加入一定质量的MnO2测定Fe2+的浓度, MnO2把Fe2+氧化为Fe3+,反应的离子方程式是2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O;(4)Ksp=6.4×10-25计算Fe3+完全沉淀时的浓度是
2MnO+CO2↑;(2)氧化剂的氧化性大于氧化产物,实验室可用软锰矿与浓盐酸反应制Cl2说明氧化性MnO2>Cl2;氯气能把Fe2+氧化为Fe3+说明氧化性Cl2>Fe3+,所以氧化性MnO2>Cl2>Fe3+;(3)MnO2的氧化性大于Fe3+,溶液I中加入一定质量的MnO2测定Fe2+的浓度, MnO2把Fe2+氧化为Fe3+,反应的离子方程式是2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O;(4)Ksp=6.4×10-25计算Fe3+完全沉淀时的浓度是![]() ,c(OH-)=
,c(OH-)=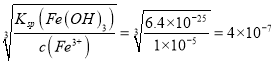 , c(H+)=
, c(H+)=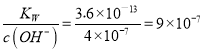 ,PH=
,PH=![]() =6;(5)反应②是MnO与硫酸生成MnSO4和水,所以溶液Ⅰ的主要成分为MnSO4;反应⑤加入(NH4)2S是除去溶液中的重金属离子Cu2+、Hg2+,所以滤渣B的主要成分为CuS、HgS;(6)阳极发生氧化反应,锰酸钾生成高锰酸钾发生氧化反应,所以阳极反应是锰酸钾生成高锰酸钾,阳极电极反应是MnO42-- e-=== MnO4-。
=6;(5)反应②是MnO与硫酸生成MnSO4和水,所以溶液Ⅰ的主要成分为MnSO4;反应⑤加入(NH4)2S是除去溶液中的重金属离子Cu2+、Hg2+,所以滤渣B的主要成分为CuS、HgS;(6)阳极发生氧化反应,锰酸钾生成高锰酸钾发生氧化反应,所以阳极反应是锰酸钾生成高锰酸钾,阳极电极反应是MnO42-- e-=== MnO4-。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案