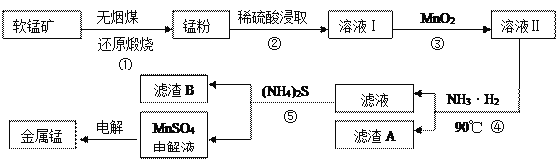
��Ŀ����
����Ŀ������Ԫ�ؼ��仯�����ڿ�ѧ�о����������������Ź㷺����;
��1��������ԭ����ͭʱ�������ĺ�ɫ���ʣ���ȴ�����ϡ���ᷢ����Һ�ʵ���ɫ��д���������������ӷ���ʽ__________________________��
��2��ȡ���Ͻ𣨺���90����1.5 g �������� ����ǡ����ȫ��Ӧ���Ͻ��������ɷֲ��μӷ�Ӧ������ȥ���������Һ����0.6 molL-1 �İ�ˮʹAl3+ ǡ����ȫ�������������Ͻ�����ᷴӦ�Ĺ�������������_____L����״������ʹAl3+ ǡ����ȫ����ʱ�����İ�ˮ____mL��
���𰸡� Cu2O+2H+=Cu+Cu2++H2O 1.68L 250mL
�������������������1��������ԭ����ͭʱ��������ɫ���ʣ���һ��������ͭ��ԭΪ������ͭ��������ͭ�����ᷴӦ��������ͭ��ͭ��ˮ����2���������ᷴӦ�ķ���ʽ��![]() ���Ȼ����백ˮ��Ӧ�Ļ�ѧ����ʽ��
���Ȼ����백ˮ��Ӧ�Ļ�ѧ����ʽ��![]() �����ݷ���ʽ���㡣
�����ݷ���ʽ���㡣
��������1���������Ϸ�����������ԭ����ͭʱ��������ɫ���ʣ���һ��������ͭ��ԭΪ������ͭ��������ͭ�����ᷴӦ��������ͭ��ͭ��ˮ����Ӧ�����ӷ���ʽ��Cu2O+2H+=Cu+Cu2++H2O��
��2�������������������VL�������������������ʵ���xmol;
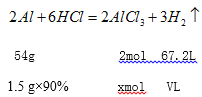
![]() �����V=1.68L��
�����V=1.68L�� ![]() ���x=0.05mol��
���x=0.05mol��
�����İ�ˮVL��
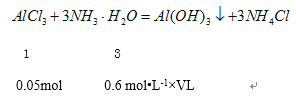
![]() �����V=0.25L=250mL��
�����V=0.25L=250mL��

 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�����Ŀ������ǰ�����ڵ�5��Ԫ�صIJ�����Ϣ���±���ʾ��
Ԫ�ش��� | Ԫ�ز�����Ϣ |
X | X�������Ӻ�������ƾ������� |
Y | ԭ�ӵ��ܼ�����3��δ�ɶԵ��ӣ��������̬�⻯����ˮ�е��ܽ����ͬ��Ԫ�����γɵ������̬�⻯������� |
Z | ��̬ԭ�ں�����3���ܼ�����˵��ӣ���������ܼ��ĵ���������ǰ�����ܼ��ĵ�����֮�� |
R | Ԫ��ԭ�ڵ�Χ�����Ų�ʽΪnsn-1npn-1 |
T | һ�ֺ��ص�������Ϊ65��������Ϊ36 |
��������Ԫ����Ϣ���ش���������:
��1����̬T2+�ĵ����Ų�ʽΪ____________��
��2��Y.Z.R �ĵ縺���ɴ�С��˳��Ϊ____________ (��Ԫ�ط��ű�ʾ)��
��3��YX4+�Ŀռ乹��Ϊ____________��������Yԭ�ӵ��ӻ��������Ϊ____________ ��YX4+����ʽΪ________��
��4��YX3��һ�ֵȵ����������______��YX3 �ļ��Ǵ���X2Z�ļ��ǵ���Ҫԭ����________��
��5��T���ʲ�����YX3��Һ��Ҳ������X2Z��Һ�������������ǵĻ����Һ������Ҫԭ�����γ����ȶ���[T(YX3)4]2+��1mol���������й�����______mol ������
��6��Z��T��ɵľ����ṹ����ͼ��ʾ����֪Z��Tԭ�ӵİ뾶�ֱ�Ϊapm��bpm�������߳�Ϊcpm����þ�����ԭ�ӵĿռ�������Ϊ________(�ô���ʽ��ʾ)��