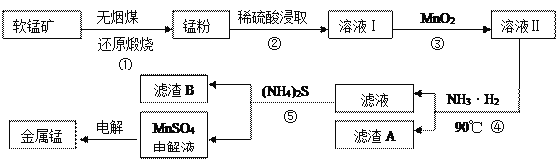
题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: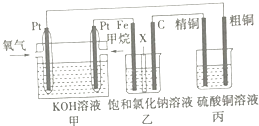
(1)甲烷燃料电池正极反应式是 .
(2)乙装置中阳离子通过X膜向极(填“Fe”或“C”)移动,石墨(C)极的电极反应式为 .
(3)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为g,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
【答案】
(1)O2+2H2O+4e﹣═4OH﹣
(2)Fe;2Cl﹣﹣2e﹣═Cl2↑
(3)12.8;减小
【解析】解:(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,电极反应式为:O2+2H2O+4e﹣═4OH﹣;所以答案是:O2+2H2O+4e﹣═4OH﹣;(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳离子通过X膜向阴极移动,所以阳极石墨上氯离子放电生成氯气,电极反应式为:2Cl﹣﹣2e﹣═Cl2↑;所以答案是:Fe;2Cl﹣﹣2e﹣═Cl2↑;(3)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌失电子进入溶液,反应式为:Zn﹣2e﹣=Zn2+、Cu﹣2e﹣=Cu2+ , 阴极上析出铜,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小; 根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2﹣﹣﹣﹣2H2﹣﹣﹣﹣2Cu,设生成铜的质量是x.O2~2H2~2Cu
22.4L 128g
2.24L x
x=12.8g
所以答案是:12.8g;减小.

练习册系列答案
相关题目