题目内容
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为______________ g.
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为____________________.
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
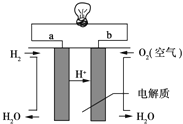
①氢氧燃料电池的总反应化学方程式是:__________________.
②电池工作一段时间后硫酸溶液的浓度___________(填“增大”、“减小”或“不变”).
【答案】Cu6.4gB2H2+O2=2H2O减小
【解析】
(1)该电池反应中铜失去电子发生氧化反应,做负极,当线路中转移0.2mol电子时,反应的铜为0.1mol,质量为6.4g;(2) 铜和铝插入浓硝酸溶液中,金属铝会钝化,金属铜和浓硝酸之间发生自发的氧化还原反应,此时金属铜做负极,金属铝做正极,插入氢氧化钠溶液中,金属铜和氢氧化钠溶液不反应,铝和氢氧化钠溶液发生自发的氧化还原反应,此时金属铝做负极,铜做正极。 (3) ①氢氧燃料电池中通入氧气的一极为正极,通入氢气的一极为负极,总反应为 2H2+O2=2H2O,②根据总反应分析,电池工作一段时间后,生成水,使溶液的体积增大,则硫酸的浓度减小。

 通城学典默写能手系列答案
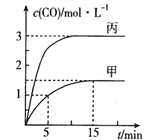
通城学典默写能手系列答案【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T1 |
起始量 | 1mol C(s) 1mol H2O(g) | 1mol CO(g) 1mol H2(g) | 3mol C(s) 2mol H2O(g) |
下列说法正确的是
A. 甲容器中,反应在5~15mim间的平均速率v(CO)=0.15mol·L-1·min-1
B. 温度为T1℃时,反应的平衡常数K=9
C. 乙容器中,若平衡时n(C)=0.2mol,则T2<T1
D. 丙容器的体积V=0.4
【题目】控制变量是科学研究的重要方法。相同质量的铁粉与足量稀硫酸分别在下列条件下发生反应,其中反应速率最快的是
A | B | C | D | |
t/℃ | 10 | 10 | 40 | 40 |
c(H2SO4 )/(mol/L) | 1 | 3 | 1 | 3 |
A. AB. BC. CD. D