题目内容
【题目】硫﹣氨热化学循环制氢示意图如下: 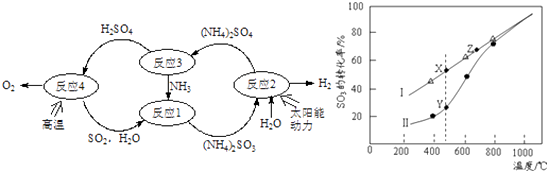
(1)反应1的离子方程式为 .
(2)反应2能量转化主要方式为 .
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同.若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色.则400℃时硫酸铵分解的化学方程式为 .
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l)=SO3(g)+H2O(g),△H=+177kJmol﹣1…(a)
2SO3(g)2SO2(g)+O2(g),△H=+196kJmol﹣1…(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: .
②在恒温密闭容器中,控制不同温度进行SO3分解实验.以SO3起始浓度均为cmolL﹣1 , 测定SO3的转化率,结果如图2,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率.
(i)图中点X与点Z的平衡常数K:
K(X)K(Z)(选填:>,<,=);
(ii)Y点对应温度下的反应速率:
v(正)v(逆)(选填:>,<,=);
(iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: .
【答案】
(1)SO2+H2O+2NH3=2NH4++SO32﹣
(2)太阳能转化为电能再转化为化学能
(3)3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑
4NH3↑+N2↑+3SO2↑+6H2O↑
(4)2H2SO4(l)?2SO2(g)+O2(g)+2H2O(g)△H=+550kJ?mol﹣1;<;>;温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡)
【解析】解:(1)反应1是二氧化硫和氨气在水中反应生成亚硫酸铵的反应,反应的离子方程式为SO2+H2O+2NH3=2NH4++SO32﹣ , 所以答案是:SO2+H2O+2NH3=2NH4++SO32﹣;(2.)据图分析,反应2是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,所以答案是:太阳能转化为电能再转化为化学能;
(3.)硫酸铵在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,则为氮气,B能使湿润的红色石蕊试纸变蓝,为氨气,C能使品红溶液褪色,为二氧化硫,反应的化学方程式为3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑,所以答案是:3(NH4)2SO4
4NH3↑+N2↑+3SO2↑+6H2O↑,所以答案是:3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑;
4NH3↑+N2↑+3SO2↑+6H2O↑;
(4.)①已知H2SO4(l)=SO3(g)+H2O(g),△H=+177kJmol﹣1…(a)
2SO3(g)2SO2(g)+O2(g),△H=+196kJmol﹣1…(b)
据盖斯定律,2a+b得:2H2SO4(l)2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol﹣1 ,
所以答案是:2H2SO4(l)2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol﹣1;
②i)据图可知,随温度的升高,三氧化硫的平衡转化率增大,说明三氧化硫分解是吸热反应,温度越高,平衡常数越大,所以K(X)<K(Z),所以答案是:<;
ii)Y点时反应还没有达到平衡状态,正向进行,所以正反应速率大于逆反应速率,所以答案是:>;
iii)温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
所以答案是:温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡).
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).