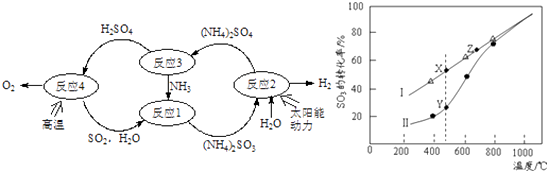
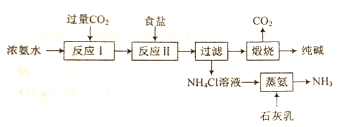
题目内容
【题目】Cu(OH)2在水中存在着如下溶解平衡:Cu(OH)2 (s)Cu2+(aq)+2OH﹣ (aq),在常温下Ksp[Cu(OH)2]=2×10﹣20 . 某CuSO4溶液中,c(Cu2+)=0.02molL﹣1 , 在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于( )
A.2
B.3
C.4
D.5
【答案】D
【解析】解:氢氧化铜的溶度积:Ksp=c(Cu2+)[c(OH﹣)]2=2×10﹣20 , c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则氢氧根离子的物质的量浓度至少为:c(0H﹣)= ![]() mol/L=1×10﹣9mol/L, 所以溶液中氢离子浓度为:c(H+)=
mol/L=1×10﹣9mol/L, 所以溶液中氢离子浓度为:c(H+)= ![]() mol/L=10﹣5mol/L,
mol/L=10﹣5mol/L,
所以溶液的pH=5,若要生成Cu(OH)2沉淀,应调整溶液pH>5,
故选D.

练习册系列答案
相关题目