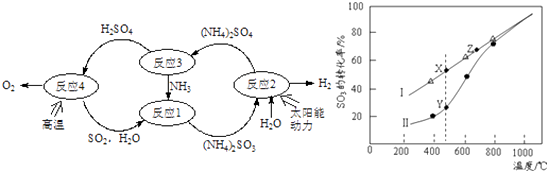
题目内容
【题目】25℃时加水稀释10mL pH=11的氨水,下列判断正确的是( )
A.原氨水的浓度为10﹣3mol?L﹣1
B.溶液中 ![]() 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
【答案】D
【解析】解:A.一水合氨是弱电解质,在水溶液里部分电离,所以原氨水的浓度>10﹣3mol/L,故A错误; B.加水稀释氨水,促进一水合氨电离,导致溶液中n(NH4+)增大、n(NH3 . H2O)减小,则溶液中 ![]() 增大,故B错误;
增大,故B错误;
C.加水稀释促进一水合氨电离,溶液中c(OH﹣)减小,温度不变,则水的离子积常数不变,则溶液中c(H+)增大,故C错误;
D.常温下,pH=3的盐酸浓度小于pH=11的氨水浓度,二者等体积混合,氨水过量,一水合氨电离程度大于铵根离子水解程度,导致混合溶液呈碱性,则pH>7,故D正确;
故选D.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

【题目】阅读、分析下列两个材料: 材料一:如图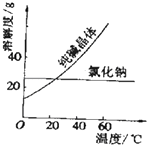
材料二:如表
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇C2H6O2 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项,):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)分离汽油和水的最佳方法是;
(2)去除纯碱中的少量氯化钠杂质,最好应用;
(3)将乙二醇和丙三醇相互分离的最佳方法是 .