题目内容
【题目】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目:该反应中氧化产物与还原产物的质量比是 , 0.1mol KIO3参加反应时转移电子mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是 A.Na2SO4溶液B.酒精 C. CCl4 D.食盐水
所用的分离方法是 , 所用仪器是 , 你怎么判断该食盐中是否含碘 .
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4mL,配制中需要用到的主要玻璃仪器是(填序号) . A.100mL量筒 B.托盘天平 C.玻璃棒D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
【答案】
(1) ;5:1;0.5
;5:1;0.5
(2)C;萃取分液;分液漏斗;静置分层后下层溶液为紫红色则说明有碘
(3)27.8;CEFGH
(4)ACD
【解析】解:(1)反应KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4的反应实质是  ,在此反应中,氧化产物与还原产物均为I2 , 且物质的量之比为5:1,故质量之比为5:1;反应中当有1molKIO3反应时,转移5mol电子,故当0.1mol KIO3参加反应时转移电子0.5mol, 故答案为:
,在此反应中,氧化产物与还原产物均为I2 , 且物质的量之比为5:1,故质量之比为5:1;反应中当有1molKIO3反应时,转移5mol电子,故当0.1mol KIO3参加反应时转移电子0.5mol, 故答案为:  ;5:1;0.5;(2)I2在有机溶剂中的溶解度大于在水中的溶解度,故将I2从K2SO4溶液中分离,应采取萃取分液的方法来分离,使用的主要仪器是分液漏斗,选用的萃取剂的应同时满足以下要求:碘单质在萃取剂中的溶解度大于在水中的溶解度;萃取剂与水互不相溶;溶质、萃取剂和水三者间互不反应,故应选四氯化碳,萃取后,由于四氯化碳的密度比水大,故分液后碘的四氯化碳溶液在下层,呈紫红色,故答案为:C;萃取分液;分液漏斗;静置分层后下层溶液为紫红色则说明有碘;(3)设需要的浓硫酸的体积为VmL,根据溶液的稀释定律可知:1mol/L×500mL=18mol/L×VmL,解得:V=27.8mL;配制一定物质的量浓度的溶液的步骤是:计算、量取、稀释、移液、洗涤、定容、摇匀可知选用的仪器是50mL量筒、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故选CEFGH,故答案为:27.8;CEFGH;(4)A.溶解后溶液没有冷却到室温就转移,则冷却后溶液体积偏小,则浓度偏高,故A选;
;5:1;0.5;(2)I2在有机溶剂中的溶解度大于在水中的溶解度,故将I2从K2SO4溶液中分离,应采取萃取分液的方法来分离,使用的主要仪器是分液漏斗,选用的萃取剂的应同时满足以下要求:碘单质在萃取剂中的溶解度大于在水中的溶解度;萃取剂与水互不相溶;溶质、萃取剂和水三者间互不反应,故应选四氯化碳,萃取后,由于四氯化碳的密度比水大,故分液后碘的四氯化碳溶液在下层,呈紫红色,故答案为:C;萃取分液;分液漏斗;静置分层后下层溶液为紫红色则说明有碘;(3)设需要的浓硫酸的体积为VmL,根据溶液的稀释定律可知:1mol/L×500mL=18mol/L×VmL,解得:V=27.8mL;配制一定物质的量浓度的溶液的步骤是:计算、量取、稀释、移液、洗涤、定容、摇匀可知选用的仪器是50mL量筒、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故选CEFGH,故答案为:27.8;CEFGH;(4)A.溶解后溶液没有冷却到室温就转移,则冷却后溶液体积偏小,则浓度偏高,故A选;
B.转移时没有洗涤烧杯、玻璃棒,会造成溶质的损失,则浓度偏低,故B不选;
C.向容量瓶加水定容时眼睛俯视液面,则溶液体积偏小,则浓度偏高,故C选;
D.用量筒量取浓硫酸后洗涤量筒,但洗涤液不能转移到容量瓶中,否则溶质偏多,则浓度偏高,故D选;
E.摇匀后发现液面低于刻度线是正常的,又加蒸馏水至刻度线则会造成浓度偏低,故E不选.
故选ACD.
(1)根据氧化还原反应中化合价的升降情况来标电子转移情况;根据化合价的变化情况分析出氧化产物和还原产物;根据化合价的变化情况分析出电子的转移的物质的量;(2)分离I2和K2SO4溶液用萃取的方法,而萃取水溶液中的碘单质,可以用四氯化碳做萃取剂;(3)利用稀释定律C浓V浓=C稀V稀来计算;根据配制一定物质的量浓度的溶液的步骤是:计算、量取、稀释、移液、洗涤、定容、摇匀来选择使用的仪器;(4)根据C= ![]() ,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.

【题目】阅读、分析下列两个材料: 材料一:如图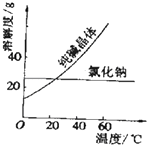
材料二:如表
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇C2H6O2 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项,):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)分离汽油和水的最佳方法是;
(2)去除纯碱中的少量氯化钠杂质,最好应用;
(3)将乙二醇和丙三醇相互分离的最佳方法是 .