题目内容
【题目】某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用_______式滴定管,该滴定实验可使用的指示剂为_______,达到滴定终点的现象为____________________________
(2)样品中氨的质量分数表达式为__________________________
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为________mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
【答案】碱 酚酞(或甲基红) 滴入最后一滴标准液后,溶液由无色突变为淡红色,且半分钟内不褪色(颜色变化要对应指示剂) ![]() 2.8×10-3
2.8×10-3
【解析】
(1)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中;NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂;根据选择的指示剂判断颜色变化;
(2)根据所用标准液求出剩余盐酸的量,再根据氨气反应盐酸之间的关系式计算氨气的质量,再根据质量分数公式计算氨质量分数;
(3)根据离子积常数计算c(CrO42-);
(1)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中,所以用NaOH标准溶液确定过剩的HCl时,应使用碱式滴定管盛放NaOH溶液;NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂,所以可以选取酚酞或甲基红作指示剂;盐酸呈酸性,酚酞遇酸不变色,随着滴入氢氧化钠溶液pH增大,酚酞在pH为8.2~10.0时显淡红色,故滴定终点的现象为:滴入最后一滴标准液后,溶液由无色突变为淡红色,且半分钟内不褪色。故答案为:碱;酚酞(或甲基红);滴入最后一滴标准液后,溶液由无色突变为淡红色,且半分钟内不褪色;
(2)剩余的n(HCl)= c2molL-1 ×10-3V2L,则与氨气反应的n(HCl)=10-3V1L×c1molL-1-c2molL-1 ×10-3V2L=10-3(c1V1-c2V2)mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)=10-3(c1V1-c2V2)mol,氨的质量分数=![]() ,故答案为:
,故答案为:![]() ;
;
(3)Ksp(Ag2CrO4)= c2(Ag+)·c(CrO42-)=1.12×10-12,故当c(Ag+)=2.0×10-5mol·L-1 时,c(CrO42-)=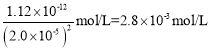 ,故答案为:2.8×10-3。
,故答案为:2.8×10-3。

【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。

请回答下列问题:
(1)步骤I中除了2Li + 2H2O=2 Li OH + H2↑反应外,主要发生的化学反应方程式为____________________。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D