题目内容
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用_______(填两条)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为________________________。
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的______________溶液(填化学式),____________,洗涤、灼烧得到铁红。
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是__________________________。
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=___________mol·L1。
(6)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=__________。
【答案】加热、搅拌和适当增大硫酸浓度等 2Co3++H2O2=2Co2++O2↑+2H NaOH 过滤 产生Cl2污染环境 1.0×107 2
【解析】
(1)从影响化学反应的速率的外界因素寻找适当的措施;
(2)氧化性Co3>H2O2,故Co3为氧化剂,H2O2为还原剂,以此写出化学方程式;
(3)滤渣B中含有氢氧化铁和氢氧化铝,氢氧化铝可溶于强碱溶液,以此分离;
(4)由于氧化性Co3>Cl2,使用浓盐酸会产生氯气污染环境;
(5)根据Ksp和pH结合水的离子积计算c(Al3);
(6)根据公式n=m/M,计算CoCl2和H2O的物质的量之比即可。
(1)由影响化学反应的速率的外界因素可知加热、搅拌和适当增大硫酸浓度等可加快溶解速率,故答案为:加热、搅拌和适当增大硫酸浓度等;
(2)由氧化性Co3>H2O2,故Co3为氧化剂生成Co2,H2O2为还原剂生成O2,则化学方程式为:2Co3++H2O2=2Co2++O2↑+2H,故答案为:2Co3++H2O2=2Co2++O2↑+2H;
(3)溶液B中含Fe3、Co2、Al3等调节pH滤渣B中含有氢氧化铁和氢氧化铝,氢氧化铝可溶于强碱溶液,过滤可分离,故答案为:NaOH;过滤;
(4)由于氧化性Co3>Cl2,使用浓盐酸会发生反应:![]() Cl2污染环境,故答案为:产生Cl2污染环境;
Cl2污染环境,故答案为:产生Cl2污染环境;
(5)由![]() 和pH=5结合水的离子积则
和pH=5结合水的离子积则![]() 则铝离子浓度
则铝离子浓度![]() ,故答案为1.0×107 ;
,故答案为1.0×107 ;
(6)![]() ,
,![]() ,
,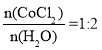 ,故答案为:2。
,故答案为:2。

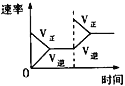
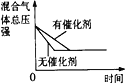
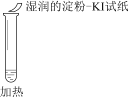
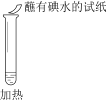
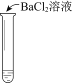
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
【题目】氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1_____0,ΔH 3_____0。(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=______kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是_______(填字母)。
A. 
B. 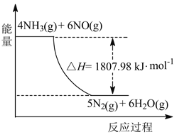
C. 
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为______kJ。
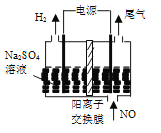
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为______。
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)