题目内容
17.下列实验方案能达到实验目的是( )| A. |  用图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| B. |  用图所示装置,制备并收集少量NO2气体 | |
| C. |  用图所示装置,可用于制备和收集乙酸乙酯 | |
| D. | 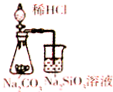 用图所示装置,证明非金属性强弱:Cl>C>Si |
分析 A.氯化铝溶液加热时易水解;
B.NO2气体与水发生反应;
C.大肚瓶能防止发生倒吸;
D.比较非金属性,应根据最高价氧化物的水化物的酸性比较.
解答 解:A.因为AlCl3是挥发性酸所形成的铝盐,加热促进AlCl3水解,以致完全得到Al(OH)3,HC1则挥发掉,故A错误;
B.NO2气体与水发生反应,不能采用排水法收集,故B错误;
C.大肚瓶能防止发生倒吸,可制备乙酸乙酯,故C正确;
D.判断非金属性的强弱可以用最高价氧化物的水化物的酸性强弱来判断而HCl不是最高价的含氧酸,故D错误.
故选C.
点评 本题考查实验方案的评价,为高频考点,侧重于物质的分离、制备以及收集,题目难度不大,注意相关物质的性质的把握.

练习册系列答案
相关题目
7.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O32-+2H2O,下列说法正确的是( )
| A. | x=2 | |
| B. | 参加反应的Fe2+全部作还原剂 | |
| C. | 每生成1 mol Fe3O4,被S2O${\;}_{3}^{2-}$还原的O2为0.5 mol | |
| D. | 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol |
5.下列叙述正确的是( )
| A. | H2O分子中各原子最外层都满足8电子结构 | |
| B. | CO2分子中含有非极性共价键 | |
| C. | 16gCH4与17gNH3所含原子数相等 | |
| D. | 32S与33S原子序数相同 |
12.下列离子方程式的书写与结论均合理的是( )
| 选项 | 离子方程式 | 结论 |
A | AgCl悬浊液中滴加2滴饱和KI溶液: AgCl(s)+I-(aq)?AgI(s)+Cl-(aq) | 溶解度:AgI>AgCl |
| B | FeCl2溶液中滴加H202: Fe2++H202+2H+═Fe3++2H20 | 氧化性:H202>Fe3+ |
| C | 少量S02通入到Na2Si03溶液中: S02+H20+Si032-═H2Si03(胶体)+S032- | 酸性:H2S03>H2Si03 |
| D | 铜与浓硫酸共热: Cu+4H++S042-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++S02↑+2H20 | 浓硫酸具有酸性、强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
2.下列变化属于吸热反应的是 ①液态水汽化 ②将胆矾加热变为白色粉末③浓硫酸稀释 ④氯酸钾分解⑤生石灰跟水反应( )
| A. | ②④ | B. | ①④ | C. | ②③ | D. | ①④⑤ |
9.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6g铁由原子变成离子时,失去的电子数一定为0.2NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数 | |
| C. | 28g氮气所含的原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为8:1 |
7.配制250mL 0.1mol•L-1盐酸溶液时,下列实验操作会使配制溶液浓度偏低的是( )
| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓盐酸时,用水洗涤量筒2~3次,洗液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |