题目内容
7.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O32-+2H2O,下列说法正确的是( )| A. | x=2 | |
| B. | 参加反应的Fe2+全部作还原剂 | |
| C. | 每生成1 mol Fe3O4,被S2O${\;}_{3}^{2-}$还原的O2为0.5 mol | |
| D. | 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol |
分析 从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,
反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂.
解答 解:A.反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,则x=4,故A错误;
B.反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,故B错误;
C.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,各转移2mol个电子,消耗1molO2为氧化剂,则被S2O${\;}_{3}^{2-}$还原的O2为0.5 mol,故C正确;
D.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为$\frac{1}{4}$mol,故D错误.
故选C.
点评 本题考查氧化还原反应,题目难度中等,明确各元素的化合价变化是解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.打破“生命力论”的科学家是( )
| A. | 道尔顿 | B. | 贝采利乌斯 | C. | 维勒 | D. | 爱因斯坦 |
15.下表是几种电解质的电离常数(25℃)电解质的强弱判断正确的是( )
| 电解质 | a.HF | b.HNO2 | c.HCN | d.NH3.H2O | e.H2S |
| 电离平衡常数 | 7.2×10-4 | 4.6×10-4 | 4.9×10-10 | 1.8×10-5 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | e最弱 | B. | b最强 | ||
| C. | 由强到弱的顺序为a>b>d>e>c | D. | 无法确定 |
2.下列实验操作中错误的是( )
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
12.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向稀的苯酚水溶液中滴加饱 和溴水 | 生成白色沉淀 | 产物三溴苯酚溶于水 |
| C | 向含I-的无色溶液中滴加少量铁盐溶液,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Fe3+>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
17.下列实验方案能达到实验目的是( )
| A. |  用图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| B. |  用图所示装置,制备并收集少量NO2气体 | |
| C. |  用图所示装置,可用于制备和收集乙酸乙酯 | |
| D. | 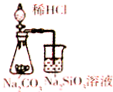 用图所示装置,证明非金属性强弱:Cl>C>Si |
 ;Z2X4结构式
;Z2X4结构式 .
.