题目内容
8.下列有关说法正确的是BFG;A.用pH试纸测得新制氯水的pH为4
B. 碳酸钠和硫酸钡可按溶解、过滤、蒸发的操作顺序分离
C. 除去C2H50H中的CH3COOH,先加足量的氢氧化钠溶液,再分液
D. 溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,则溶液中一定存在SO42-
E.将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,检验气体中是否含有乙烯
F.金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物;非金属氧化物不一定是酸性氧化物,酸性氧化物也不一定是非金属氧化物
G.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体.在同温同压下,两容器内的气体一定具有相同的原子数.
H.实验室配制1mol/L的盐酸250mL,需要的仪器只有:250mL容量瓶、胶头滴管、量筒、烧杯
I.将50g溶质质量分数为w1,物质的量浓度为C1的浓硫酸加入到V mL水中,稀释后得到的溶质的质量分数为w2,物质的量浓度为C2的稀溶液.若C1=2C2,则w1>2w2;V<50mL
J.有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸.在水溶液中符合离子方程式:2H++SO32-═SO2↑+H2O的化学反应的组合共有9个
K.在NH4Al(SO4)2(一种复盐)的溶液中加入Ba(OH)2溶液至沉淀的质量达到最大时:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O
L.硝酸钡溶液中通入足量的SO2:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+.
分析 A.氯水中含HClO,具有漂白性;
B.碳酸钠能够溶解于水,而硫酸钡不能;
C.乙酸与氢氧化钠反应生成乙酸钠;
D.能和氯化钡溶液产生白色沉淀的有硫酸根离子、银离子;
E.乙醇、二氧化硫都能被酸性高锰酸钾溶液氧化;
F.金属氧化物可以是酸性氧化物或两性氧化物;非金属氧化物可以是不成盐氧化物;
G.每个分子中原子个数相等;
H.根据配制一定物质的量浓度的溶液步骤选用仪器;
I.设物质的量是浓度为c1 mol•L-1的密度为ρ1,物质的量是浓度为c2mol•L-1硫酸溶液的密度为ρ2.利用c=$\frac{1000ρω}{M}$公式变形计算硫酸的质量分数,结合硫酸溶液的浓度越大密度越大,进行判断;稀释前后溶质的质量不变,结合质量分数关系,判断稀释后溶液的质量小于100g,故水的质量小于50g,据此判断水的体积;
J.离子方程式为2H++SO32-═SO2↑+H2O,为强酸与可溶性亚硫酸盐反应生成可溶性盐、水、二氧化硫的反应;
K.化学变化过程:①NH4++OH-=NH3•H2O; ②Al3++OH-=Al(OH)3↓;③Ba2++SO42-=BaSO4↓ 两溶液混合后先发生反应②,当Al3+反应完了,OH-才和NH4+反应;
L.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚硫酸根离子.
解答 解:A.氯水中含HClO,具有漂白性,不能利用pH试纸测定氯水的pH,应利用pH计,故A错误;
B.碳酸钠能够溶解于水,而硫酸钡不能,所以可以用上述方法分离,故B正确;
C.乙酸与氢氧化钠反应生成乙酸钠,易乙醇不分层,无法分离,故C错误;
D.能和氯化钡溶液产生白色沉淀的有硫酸根离子、银离子,所以不能据此判断溶液中一定含有硫酸根离子,故D错误;
E.乙醇具有还原性和挥发性,乙醇将浓硫酸还原生成二氧化硫,所以生成的乙烯中含有乙醇、二氧化硫,这些物质都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,应该先用NaOH溶液除去二氧化硫、乙醇,然后用酸性高锰酸钾溶液或溴水检验乙烯,故E错误;
F.金属氧化物可以是酸性氧化物或两性氧化物,如:Mn2O7是酸性氧化物,Al2O3是两性氧化物;非金属氧化物可以是不成盐氧化物;如CO属于非金属氧化物但不属于酸性氧化物,故F正确;
G.根据N=nNA知,二者的物质的量与分子数成正比,物质的量相等则其分子数相等,每个分子中原子个数相等,所以其原子总数相等,故G正确;
H.实验室配制1 mol/L的盐酸250 mL,需要的仪器除了:250 mL容量瓶、胶头滴管、量筒、烧杯外,还需要玻璃棒,故H错误;
I.设物质的量是浓度为c1 mol•L-1的密度为ρ1,物质的量是浓度为c2mol•L-1硫酸溶液的密度为ρ2,由c=$\frac{1000ρw}{M}$可知,W1=$\frac{98{c}_{1}}{1000ρ{\;}_{1}}$,W2=$\frac{98c{\;}_{2}}{1000ρ{\;}_{2}}$,所以$\frac{w{\;}_{1}}{w{\;}_{2}}$=$\frac{{c}_{1}{ρ}_{2}}{{c}_{2}ρ{\;}_{1}}$,由于c1=2c2,所以$\frac{w{\;}_{1}}{w{\;}_{2}}$=$\frac{c1ρ2}{c2ρ1}$=$\frac{2ρ2}{ρ1}$,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以w1<2w2;稀释前后溶质的质量不变,所以稀释后溶液的质量小于100g,故水的质量小于50g,水的密度为1g/mL,所以水的体积V<50mL,故I不正确;
J.亚硫酸的钾盐、钠盐、铵盐、钡盐中,BaSO3不溶于水,离子方程式中不能用SO32-表示,其余在溶液中均可用SO32-表示,四种酸中,醋酸是弱酸,离子方程式中不能用H+表示,HNO3有强氧化性,与SO32-反应时生成SO42-,离子方程式也不符合,则符合2H++SO2-═SO2↑+H2O,存在三种盐与两种酸可组合出6个反应,且离子方程式相同,故J错误;
K.两溶液混合后NH4+、Al3+与OH-都能反应,根据NH4+、Al3+与OH-的性质,OH-先与Al3+反应,当溶液中Al3+反应完后,才发生NH4+与OH-的反应,反应不生成偏铝酸根,故K错误;
L.过量SO2通入Ba(NO3)2溶液,二氧化硫过量,反应按照硝酸钡进行,正确的离子方程式为3SO2+2NO3-+Ba2++2H2O═BaSO4↓+2SO42-+2NO+4H+,故L错误.
故答案为:BFG.
点评 本题考查内容较多,题目难度中档,本题注意相关物质的性质的异同,为解答该题的关键,学习中注意相关基础知识的积累.

| A. | 道尔顿 | B. | 贝采利乌斯 | C. | 维勒 | D. | 爱因斯坦 |
| A. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 电解MgCl2水溶液的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |
| A. | 水溶液中:Na+、K+、N03- | |
| B. | 空气中:CO2、S02、NO | |
| C. | 氢氧化铁胶体中:H+、K+、I- | |
| D. | 高锰酸钾溶液中:H+、S042-、CH3CH2OH |
| A. |  用图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| B. |  用图所示装置,制备并收集少量NO2气体 | |
| C. |  用图所示装置,可用于制备和收集乙酸乙酯 | |
| D. | 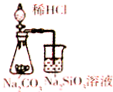 用图所示装置,证明非金属性强弱:Cl>C>Si |
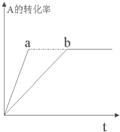 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 扩大容器的容积 | C. | 加入催化剂 | D. | 升高温度 |

 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: